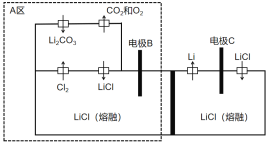
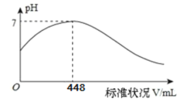
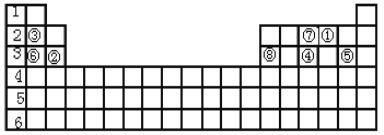
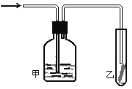
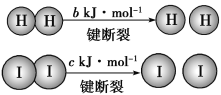
题目内容
【题目】Na、Fe、N是中学化学常见的三种元素,请依据这些元素组成的物质回答下列问题:
(1)钠可以和TiCl4反应制取金属Ti,体现钠的__性。
(2)氯碱工业是利用电解氯化钠溶液制取烧碱和氯气,其反应为:2NaCl+2H2O![]() 2NaOH+Cl2↑+H2↑,该反应的离子方程式___;氯气有毒,可以用__吸收。
2NaOH+Cl2↑+H2↑,该反应的离子方程式___;氯气有毒,可以用__吸收。
(3)写出Fe2O3的一种用途__,请设计实验证明赤铁矿中含有铁元素___。
(4)电子工业常用FeCl3溶液刻蚀印刷电路板(由高分子材料和铜箔复合而成),离子方程式为__。
(5)将一小块Cu片放入盛有稀硝酸的试管中,可观察到试管口气体颜色为__;其铜和稀硝酸反应的离子方程式为___。
【答案】还原 2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑ 氢氧化钠溶液 作颜料或冶炼铁 取少量赤铁矿溶于酸(盐酸等),滴加KSCN溶液变红,说明含铁元素 2Fe3++Cu=2Fe2++Cu2+ 红棕色 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
2OH-+H2↑+Cl2↑ 氢氧化钠溶液 作颜料或冶炼铁 取少量赤铁矿溶于酸(盐酸等),滴加KSCN溶液变红,说明含铁元素 2Fe3++Cu=2Fe2++Cu2+ 红棕色 3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O
【解析】
(1)钠和TiCl4反应制取金属Ti,Na的化合价升高;
(2)反应中气体、弱电解质写化学式;氯气可与NaOH反应;
(3)氧化铁是红棕色固体难溶于水,可以作颜料或冶炼铁;证明赤铁矿中含有铁元素,可以取少量赤铁矿溶于盐酸后滴加KSCN溶液检验是否含铁离子;
(4)工业常用FeCl3溶液刻蚀印刷电路板是氯化铁和铜反应生成氯化亚铁和氯化铜;
(5)Cu与稀硝酸反应生成硝酸铜、NO和水;NO遇到空气中的氧气反应生成红棕色的NO2。
(1)钠和TiCl4反应制取金属Ti,Na的化合价升高,表现还原性;
(2)反应中气体、弱电解质写化学式,则离子方程式为2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑;氯气可与NaOH反应,可用NaOH溶液吸收;
2OH-+H2↑+Cl2↑;氯气可与NaOH反应,可用NaOH溶液吸收;
(3)氧化铁是红棕色固体难溶于水,可以作颜料或冶炼铁;证明赤铁矿中含有铁元素,可以取少量赤铁矿溶于盐酸后滴加KSCN溶液检验是否含铁离子;
(4)工业常用FeCl3溶液刻蚀印刷电路板是氯化铁和铜反应生成氯化亚铁和氯化铜,离子反应的方程式为:2Fe3++Cu=2Fe2++Cu2+;
(5)Cu与稀硝酸反应生成硝酸铜、NO和水,反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O;NO遇到空气中的氧气反应生成红棕色的NO2。