题目内容
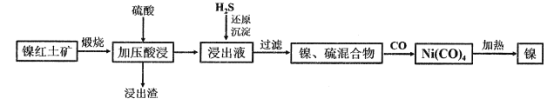
【题目】镍及其化合物在生产生活中有着极其重要的作用。现以低品位镍红土矿(主要成分为镍的氧化物、Fe2O3·H2O和SiO2等)为原料制备兰尼镍的工艺流程如图所示:
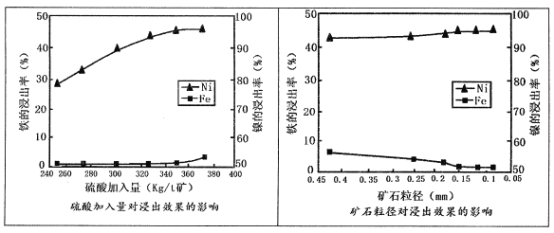
已知加压酸浸过程中的相关影响因素如下:
请回答:
(1)请根据图示,选择加压酸浸过程中硫酸的加入量和矿石粒径的最适宜条件为_______
A.260Kg/t矿;0.45mm B.320 Kg/t矿:0.25mm
C.350Kg/t矿;0.15mm D.380 Kg/t矿;0.05mm
(2)①已知镍红土矿煅烧后生成Ni2O3,而加压酸浸后浸出液中含有Ni2+,写出加压酸浸过程中镍元素所涉及的化学反应方程式____________。
②甲同学取该浸出液,控制pH为2~3,经过-系列操作,制取少量NiSO4·7H2O晶体。其控制pH为2~3的目的为____________________________________________________。
③乙同学取该浸出液,经多次处理,得到一定浓度的NiSO4溶液,往其中加入适量的NaClO和NaOH混合液,制得碱性镍电池电极材料NiOOH,该反应的离子方程式为____________。
(3)向浸出液中通入H2S气体,该反应的离子方程式为__________。
(4)下列说法正确的是________________
A.在煅烧过程中,空气宜选择从下往上的通入方式,使镍红土矿燃烧更充分
B.加压酸浸中,为加快反应速率,可选用浓硫酸
C.加压酸浸中,在最适宜条件下,浸出渣中的主要成份为SiO2和Fe2O3·H2O
D.CO为无色无味的有毒气体,故从镍硫混合物到镍的过程中,需注意通风并及时检测操作过程中是否有CO泄露
【答案】C ![]() 抑制镍离子水解防止生成
抑制镍离子水解防止生成![]() 沉淀
沉淀 ![]()
![]() ACD
ACD
【解析】
(1)根据图片可知,在350Kg/t矿的硫酸加入量,0.15mm的矿石粒径时,效果最佳,故答案选C;
(2)①已知红土镍矿煅烧后生成Ni2O3,而加压酸浸后浸出液A中含有Ni2+,说明Ni元素被还原,另外,在硫酸中只能是O元素被氧化为O2,故有关镍元素的加压酸浸的化学反应方程式为2Ni2O3+4H2SO4=4NiSO4+O2↑+4H2O;
②控制pH为2~3的目的为抑制镍离子水解防止生成![]() 沉淀;
沉淀;
③向一定浓度的NiSO4溶液中加入适量的NaClO和NaOH混合液,制得碱性镍电池电极材料NiOOH,离子方程式为![]() ;
;
(3)浸出液A中含有大量的Ni2+、少量的H+和Fe3+,通入硫化氢时,Fe3+发生还原反应,H2S+2Fe3+=2Fe2++2H++S↓;
(4)A.在煅烧过程中,空气宜选择从下往上的通入方式,使镍红土矿燃烧更充分,A正确;
B.浓硫酸中的氢离子浓度较小,故加压酸浸中,为加快反应速率,不可选用浓硫酸,B错误;
C. 加压酸浸中,在最适宜条件下,浸出渣中的主要成份为SiO2和Fe2O3·H2O,C正确;
D. CO为无色无味的有毒气体,故从镍硫混合物到镍的过程中,需注意通风并及时检测操作过程中是否有CO泄露,D正确;
故选ACD。