题目内容
键能是破坏1mol化学键吸收的热量或者生成1mol化学键放出的热量,解释下列物质性质的变化规律与物质结构间的因果关系时,与键能无关的变化规律是①HF、HCl、HBr、HI的热稳定性依次减弱②NH3易液化③F2、Cl2、Br2、I2的熔、沸点逐渐升高 ④H2S的熔沸点小于H2O的熔沸点 ⑤NaF、NaCl、NaBr、NaI的熔点依次减低( )
分析:键能是破坏1mol化学键吸收的热量或者生成1mol化学键放出的热量,键能的大小决定了物质的稳定性;共价化合物形成的分子晶体,分子的三态变化、熔沸点由分子间作用力决定,与化学键无关;离子化合物的熔沸点取决于离子键的强弱;
解答:解:①HF、HCl、HBr、HI的热稳定性依次减弱的原因是分子中的键能依次减小,所以氢化物稳定性依次减弱,和键能有关;
②NH3易液化是在一定条件下分子间作用力的改变造成了分子间距离的改变,从而引起状态的改变,与键能无关;
③F2、Cl2、Br2、I2的熔、沸点逐渐升高,分子内形成的是共价键,所以和分子间作用力有关,与分子内的键能无关;
④H2S的熔沸点小于H2O的熔沸点,因是共价化合物,熔沸点与分子间的作用力有关与键能无关;
⑤NaF、NaCl、NaBr、NaI的熔点依次减低,是因为化合物中的离子键依次减弱,所以熔点依次降低,与化学键的键能有关;
故综上分析得出与键能无关的变化规律是②③④;
故选A.
②NH3易液化是在一定条件下分子间作用力的改变造成了分子间距离的改变,从而引起状态的改变,与键能无关;
③F2、Cl2、Br2、I2的熔、沸点逐渐升高,分子内形成的是共价键,所以和分子间作用力有关,与分子内的键能无关;
④H2S的熔沸点小于H2O的熔沸点,因是共价化合物,熔沸点与分子间的作用力有关与键能无关;
⑤NaF、NaCl、NaBr、NaI的熔点依次减低,是因为化合物中的离子键依次减弱,所以熔点依次降低,与化学键的键能有关;
故综上分析得出与键能无关的变化规律是②③④;
故选A.
点评:本题考查了分子晶体、离子晶体的熔沸点、稳定性的判断依据,主要考查了键能与分子间作用力的区别.

练习册系列答案
相关题目
(11分)下表中的数据是破坏1 mol物质中的化学键所消耗的能量(kJ):
|
物质 |
Cl2 |
Br2 |
I2 |
HCl |
HBr |
HI |
H2 |
|
能量(kJ) |
243 |
193 |
151 |
431 |
366 |
298 |
436 |
根据上述数据问题。
(1)下列物质本身具有的能量最低的是 _____(填序号)A.H2 B.Cl2 C.Br2 D.I2
化合物HCl、HBr、HI中______受热时最稳定。
(2)1molH2在2mol Cl2中燃烧,放出热量________ kJ 。一定条件下,1mol H2分别与足量Cl 2、Br2、I2反应,放出热量由多到少的顺序是________ (填序号)A Cl 2<Br2<I2 B Cl 2>Br2>I2
(3)下列有关化学键及键参数的说法中正确的是 (填序号)
① 原子或分子间的相互作用叫化学键
② 氯分子中两个氯原子间的距离是键长
③ 键长的大小与成键原子的半径和成键数目有关
④ 键角是描述分子立体结构的重要参数
(4)下列事实不能用键能的大小来解释的是 (填序号)
A.乙炔比氮气均含三键但是前者比后者容易发生加成反应
B.N2、O2、F2跟氢气的反应能力依次增强
C.硝酸是挥发性酸,而硫酸、磷酸是难不挥发性酸
(5)氰气[(CN)2]无色、剧毒、有苦杏仁味,和卤素单质性质相似。
①写出(CN)2与苛性钠溶液反应的离子方程式______________________;
②已知氰分子中键与键之间的夹角为180.,并有对称性, 则结构式为_______
③氰分子中碳原子为_______杂化;一个氰分子中包含_______个σ键,____个π键。
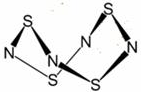 Ⅰ.S4N4的结构如图:
Ⅰ.S4N4的结构如图: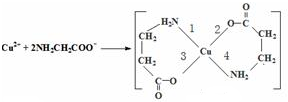
 ④卤化氢的还原性按HF、HCl、HBr、HI的顺序依次增强
④卤化氢的还原性按HF、HCl、HBr、HI的顺序依次增强