题目内容
将各0.05mol的下列物质置于500mL水中充分搅拌后,溶液中阴离子数目最多的是( )
分析:将各0.05mol的下列物质置于500mL水中充分搅拌后,根据盐类的水解和物质的溶解度思考分析.
解答:解:对于A和B,由于NH4Br和K2SO4溶于水并完全电离,所以n(Br-)=n(SO42-)=0.05mol(水电离出的OH-可忽略);对于C,C中的Mg(OH)2在水中难溶,故溶液中n(OH-)<0.1mol;对于D,在Na2S溶液中,由于S2-+H2O?HS-+OH-,阴离子数目会增加,即阴离子物质的量大于0.1mol.由上分析,Na2S溶液中的阴离子数目最多,D项正确.
故选D.
故选D.
点评:本题考查了电解质的溶解性及水解原理,把握多元弱酸根离子的分步水解即可解答,注意Mg(OH)2的溶解性,为易错点.

练习册系列答案
相关题目
某兴趣小组为探究外界条件对可逆反应 A(g)+B(g)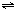 C(g)+D(s)的影响,在恒温条件下往一个容积为10L的密闭容器中充入1molA和1molB,反应达平衡时测得容器中各物质的浓度为I然后每次改变一种反应条件做了另三组实验,重新达到平衡时容器中各成分的浓度(其中D用物质的量来表达)分别为Ⅱ.Ⅲ.Ⅳ. C(g)+D(s)的影响,在恒温条件下往一个容积为10L的密闭容器中充入1molA和1molB,反应达平衡时测得容器中各物质的浓度为I然后每次改变一种反应条件做了另三组实验,重新达到平衡时容器中各成分的浓度(其中D用物质的量来表达)分别为Ⅱ.Ⅲ.Ⅳ.
|
 (2013?闸北区二模)含有硫的化合物在工业生产中应用广泛,回答下列问题:
(2013?闸北区二模)含有硫的化合物在工业生产中应用广泛,回答下列问题: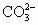 )排列序号为________.
)排列序号为________.