题目内容
用NA表示阿伏加德罗常数。下列说法中,正确的是 ( )
| A.1.8g重水(D2O)中含有的质子数为1.0 NA |
B.500℃、30MPa下:N2(g)+3H2(g) 2NH3(g);△H=-38.6kJ·mol-1;将1.5NA的H2和过量N2在此条件下充分反应,放出热量19.3kJ 2NH3(g);△H=-38.6kJ·mol-1;将1.5NA的H2和过量N2在此条件下充分反应,放出热量19.3kJ |
| C.标准状况下,11.2 L Cl2通入足量的石灰乳中制备漂白粉,转移的电子数为0.5NA |
| D.60 g石英晶体中含有的Si-O键数目为2NA |
C
重水的摩尔质量为20 g·mol-1,一个重水分子中含有10个质子,故1.8g重水中含有的质子数为1.8×10×NA /20=0.9NA,故A错。可逆反应中的反应热表示该反应完全进行到底时的热效应,由于1.5mol的H2在合成氨反应中不可能完全完全转化,因此放出的热量必小于19.3kJ,故B错。由于SiO2是呈空间网状的正四面体结构,60 g石英相当于1molSiO2,含有的Si-O键数目应为4NA,故D错。

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目
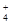 数目为2 NA
数目为2 NA