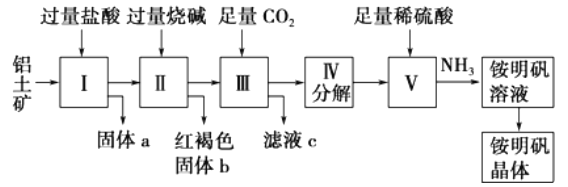
题目内容
【题目】【陕西省西安市长安区第一中学大学区2017届高三第三次联考理综】镍及其化合物用途广泛。某矿渣的主要成分是NiFe2O4(铁酸镍)、NiO、FeO、CaO、SiO2等,以下是从该矿渣中回收NiSO4的工艺路线:
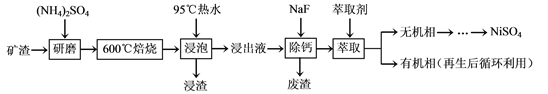
已知:(NH4)2SO4在350℃以上会分解生成NH3和H2SO4。NiFe2O4在焙烧过程中生成
NiSO4、Fe2(SO4)3。
锡(Sn)位于第五周期第ⅣA族。
(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是__________________。
(2)“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为____________________。
“浸渣”的成分除Fe2O3、FeO(OH)外还含有________(填化学式)。
(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,
加入SnCl2将Fe3+还原为Fe2+,所需SnCl2的物质的量不少于Fe3+物质的量的_______倍;
除去过量的SnCl2后,再用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为________________________。
(4)“浸出液”中c(Ca2+) = 1.0×10-3mol·L-1,当除钙率达到99%时,溶液中c(F-) = ________ mol·L-1。[已知Ksp (CaF2)=4.0×10-11]
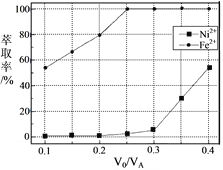
(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如下图所示,V0/VA的最佳取值是______。
【答案】增大接触面积,加快反应速率,使反应更充分
Fe3++2H2O![]() FeO(OH)↓+3H+ SiO2、CaSO4 0.5
FeO(OH)↓+3H+ SiO2、CaSO4 0.5
Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O 2.0×10-3 0.25
【解析】(1)焙烧前将矿渣与(NH4)2SO4混合研磨,混合研磨的目的是增大接触面积,加快反应速率,使反应更充分;(2))“浸泡”过程中Fe2(SO4)3生成FeO(OH)的离子方程式为 Fe3++2H2O![]() FeO(OH)↓+3H+,浸渣”的成分除Fe2O3、FeO(OH)外还含有 SiO2、CaSO4;(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+,反应为:2Fe3++Sn2+=Sn4++2Fe2+,所需SnCl2的物质的量不少于Fe3+物质的量的一半,为0.5倍;用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;(4)浸出液”中c(Ca2+) = 1.0×10-3mol·L-1,当除钙率达到99%时,剩余钙离子1%×1.0×10-3molL-1=1×10-5mol/L,溶液中c2(F-) =Ksp/c(Ca2+)=4.0×1011/1×105,所以c2(F-) =2×10-3mol/L;(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,最佳取值是亚铁离子能被萃取,镍离子不被萃取,V0/VA的最佳取值是0.25。
FeO(OH)↓+3H+,浸渣”的成分除Fe2O3、FeO(OH)外还含有 SiO2、CaSO4;(3)为保证产品纯度,要检测“浸出液”的总铁量:取一定体积的浸出液,用盐酸酸化后,加入SnCl2将Fe3+还原为Fe2+,反应为:2Fe3++Sn2+=Sn4++2Fe2+,所需SnCl2的物质的量不少于Fe3+物质的量的一半,为0.5倍;用酸性K2Cr2O7标准溶液滴定溶液中的Fe2+,还原产物为Cr3+,滴定时反应的离子方程式为:Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O;(4)浸出液”中c(Ca2+) = 1.0×10-3mol·L-1,当除钙率达到99%时,剩余钙离子1%×1.0×10-3molL-1=1×10-5mol/L,溶液中c2(F-) =Ksp/c(Ca2+)=4.0×1011/1×105,所以c2(F-) =2×10-3mol/L;(5)本工艺中,萃取剂与溶液的体积比(V0/VA)对溶液中Ni2+、Fe2+的萃取率影响如图所示,最佳取值是亚铁离子能被萃取,镍离子不被萃取,V0/VA的最佳取值是0.25。

【题目】【2017届河北衡水中学全国高三大联考(全国卷)理科综合化学试】
下列操作和现象所得结论正确的是
选项 | 操作和现象 | 结论 |
A | 其他条件不变,缩小H2(g)+I2(g) | 增大压强,平衡逆向移动 |
B | 向某溶液中滴加稀盐酸,再加KSCN溶液,溶液变为血红色 | 原溶液中一定含有Fe3+ |
C | 用滴定管量取20.00mL稀硫酸,初读数时尖嘴处有气泡,末读数时气泡消失 | 所取稀硫酸体积小于20.00mL |
D | 25℃时,分别测定等物质的量浓度的Na2C2O4溶液和NaF溶液的pH,前者pH大 | 酸性:H2C2O4<HF |