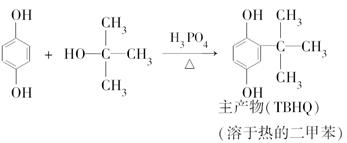
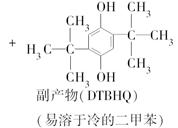
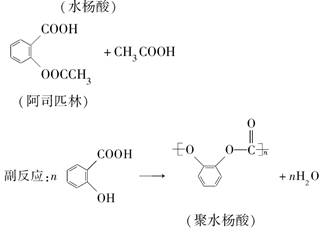
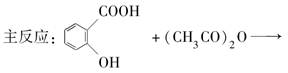题目内容
以重晶石(主要成分为BaSO4)为主要原料制备立德粉(ZnS和BaSO4的混合物)的工艺流程如下:
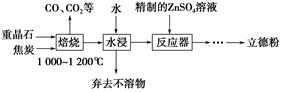
(1)焙烧时,焦炭需过量,其目的是:①____________________________;②____________________________。
(2)焙烧过程中发生的反应之一是4CO(g)+BaSO4(s) BaS(s)+4CO2(g),该反应的平衡常数的表达式为__________________________________________________。
BaS(s)+4CO2(g),该反应的平衡常数的表达式为__________________________________________________。
反应器中发生反应的化学方程式为____________________________________。
(4)用工业级氧化锌(含少量FeO和Fe2O3杂质)和硫酸制取硫酸锌溶液时,需先后加入H2O2溶液和碳酸锌精制,加入H2O2溶液时发生反应的离子方程式为
________________________________,加入碳酸锌的目的是将溶液中的Fe3+转化为红褐色沉淀,写出该反应的化学方程式:__________________________________________。

(1)焙烧时,焦炭需过量,其目的是:①____________________________;②____________________________。
(2)焙烧过程中发生的反应之一是4CO(g)+BaSO4(s)
 BaS(s)+4CO2(g),该反应的平衡常数的表达式为__________________________________________________。
BaS(s)+4CO2(g),该反应的平衡常数的表达式为__________________________________________________。反应器中发生反应的化学方程式为____________________________________。
(4)用工业级氧化锌(含少量FeO和Fe2O3杂质)和硫酸制取硫酸锌溶液时,需先后加入H2O2溶液和碳酸锌精制,加入H2O2溶液时发生反应的离子方程式为
________________________________,加入碳酸锌的目的是将溶液中的Fe3+转化为红褐色沉淀,写出该反应的化学方程式:__________________________________________。
(1)①焦炭燃烧放热,提供反应所需温度
②提高重晶石的利用率
(2)K=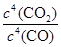
(3)BaS+ZnSO4=BaSO4↓+ZnS↓
(4)2Fe2++H2O2+2H+=2Fe3++2H2O
Fe2(SO4)3+3ZnCO3+3H2O=3ZnSO4+2Fe(OH)3+3CO2↑
②提高重晶石的利用率
(2)K=
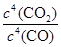
(3)BaS+ZnSO4=BaSO4↓+ZnS↓
(4)2Fe2++H2O2+2H+=2Fe3++2H2O
Fe2(SO4)3+3ZnCO3+3H2O=3ZnSO4+2Fe(OH)3+3CO2↑
(1)重晶石与焦炭反应需要高温,而焦炭燃烧可放出热量达到反应所需的高温,同时焦炭过量,必然使更多的重晶石参与反应,从而提高了重晶石的利用率。(3)由流程图可知,反应物为BaS与ZnSO4,可知它们发生复分解反应。(4)工业氧化锌用硫酸溶解时,溶液中存在Fe2+,而H2O2有强氧化性,可将其氧化为Fe3+;Fe3+在溶液中发生水解:Fe3++3H2O Fe(OH)3+3H+,加入ZnCO3与H+反应,使水解平衡向右移动,得到Fe(OH)3沉淀。
Fe(OH)3+3H+,加入ZnCO3与H+反应,使水解平衡向右移动,得到Fe(OH)3沉淀。
 Fe(OH)3+3H+,加入ZnCO3与H+反应,使水解平衡向右移动,得到Fe(OH)3沉淀。
Fe(OH)3+3H+,加入ZnCO3与H+反应,使水解平衡向右移动,得到Fe(OH)3沉淀。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 丁醇,查阅资料得知一条合成路线:
丁醇,查阅资料得知一条合成路线: CH2+CO+H2
CH2+CO+H2 CH3CH2CH2CHO
CH3CH2CH2CHO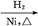 CH3CH2CH2CH2OH;
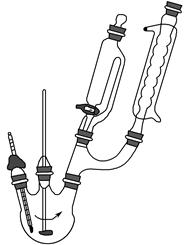
CH3CH2CH2CH2OH;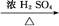 CO↑+H2O,并设计出原料气的制备装置(如图)。
CO↑+H2O,并设计出原料气的制备装置(如图)。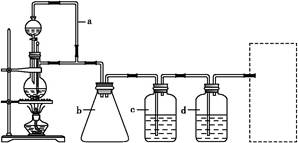
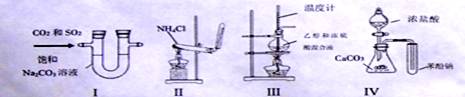
 RCH(OH)SO3Na↓;②沸点:乙醚34℃,1
RCH(OH)SO3Na↓;②沸点:乙醚34℃,1 滤液
滤液
 有机层
有机层 1
1 纯品
纯品