题目内容
4.粗食盐中含有钙离子、镁离子、硫酸根离子等可溶性杂质外,还含有泥沙等不溶性杂质,根据粗盐提纯的实验回答下列各问题.(1)将粗盐制成精盐,主要操作步骤之一是蒸发,在加热蒸发溶剂的过程中,还要进行的动手操作是(作具体,完整的说明)用玻璃棒搅拌,这样做的主要目的是防止液体飞溅,熄灭酒精灯停止加热的根据是蒸发皿中产生了较多的固体.
(2)如何运用最简方法检验溶液中有无SO42-?静置片刻后,取上层清液于试管中,继续滴加氯化钡,若出现浑浊或白色沉淀,说明溶液中含有硫酸根,否则不含硫酸根.如果有,应该如何除去SO42-?在溶液中继续加入过量的氯化钡.
(3)在粗盐经过溶解→过滤后的溶液中滴加饱和Na2CO3溶液,直至不再产生沉淀为止,请问这步操作的目的是除去Ca2+、Mg2+及加入过量的Ba2+.
分析 (1)在蒸发结晶的过程中,还需进行的手动操作是搅拌,防止液体飞溅,当有较多晶体析出时即停止加热;
(2)加入氯化钡溶液检验硫酸根离子是否除尽;
(3)在粗盐提纯的过程中需要滴加饱和Na2CO3溶液除去钙离子以及过量的钡离子.
解答 解:(1)在蒸发结晶的过程中,为了防止液体飞溅,还需进行的手动操作是搅拌;当蒸发皿中有较多晶体析出时即停止加热,利用余热将剩余液体蒸干,
故答案为:用玻璃棒搅拌,防止液体飞溅;蒸发皿中产生了较多的固体;
(2)加入过量氯化钡溶液除去硫酸根离子,检验硫酸根离子已除尽,可静止片刻在上层清液处,滴加一滴氯化钡溶液,不出现浑浊就说明硫酸根离子已经除尽,如果还有,可以在溶液中继续加入过量的氯化钡,
故答案为:静置片刻后,取上层清液于试管中,继续滴加氯化钡,若出现浑浊或白色沉淀,说明溶液中含有硫酸根,否则不含硫酸根;在溶液中继续加入过量的氯化钡;
(3)碳酸钠与镁离子生成碳酸镁沉淀、与钙离子生成碳酸钙沉淀、与钡离子生成碳酸钡沉淀,所以滴加饱和碳酸钠溶液,可以除去钙离子、镁离子和过量的钡离子,
故答案为:除去Ca2+、Mg2+及加入过量的Ba2+.
点评 本题考查在粗盐提纯的过程中所选用除杂和净化的方法,题目难度不大,注意除去杂质不要引入新的杂质,对于实验过程中过量的试剂都要除去.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
14.为确定某溶液的离子组成,分别进行如下实验:
①测定溶液的pH,溶液显强碱性.
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体.
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀.
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀.
根据实验以下推测正确的是( )
①测定溶液的pH,溶液显强碱性.
②取少量溶液加入稀盐酸至溶液呈酸性,产生无刺激性、能使澄清石灰水变浑浊的气体.
③在上述溶液中再滴加Ba(NO3)2溶液,产生白色沉淀.
④取上层清液继续滴加Ba(NO3)2溶液至无沉淀时,再滴加AgNO3溶液,产生白色沉淀.
根据实验以下推测正确的是( )
| A. | 不能确定HCO3-离子是否存在 | B. | 可能有CO32-离子 | ||
| C. | 一定有Cl-离子存在 | D. | 一定有SO42-离子 |
15.J、L、M、R、T是原子序数依次增大的短周期主族元素,J、R在周期表中的相对位置如下表;J元素最低负化合价的绝对值与其原子最外层电子数相等;M是地壳中含量最多的金属元素.
(1)元素T的最高价含氧酸具有强酸性;T在周期表中的位置是第三周期第ⅦA族.
(2)化合物甲的分子由两个J原子和两个氢原子构成,甲的电子式是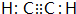 .
.
(3)一定条件下,R元素的最高价氧化物乙在固定容积的密闭容器中发生分解反应(△H>0),达到平衡后,仅改变下表中反应条件x,该平衡体系中随x递增,y递减的是ac(选填序号)
(4)L的最简单气态氢化物丙的水溶液显碱性,在微电子工业中,丙的水溶液可作H2O2的清除剂,反应的产物不污染环境,其化学方程式为NH3+3H2O2=N2+6H2O.
(5)在298K下,J、M的单质各1mol完全燃烧,分别放出热量以akJ和bkJ时.又知一定条件下,M的单质能将J从它的最高价氧化物中置换出来,写出此置换反应的热化学方程式:4Al(s)+3CO2(g)=3C(s)+2Al2O3(s)△H=(+3a-4b)kJ/mol.(注:题中所设单质均为最稳定单质)
(6)用M单质作阳极,J单质作阴极,Ca(HCO3)2溶液作电解液,进行电解,阴极生成的气体和沉淀分别是H2、CaCO3,阳极也生成气体和沉淀,写出阳极的电极反应式Al-3e-+3HCO3-=Al(OH)3+3CO2↑.
| J | ||||
| R |
(2)化合物甲的分子由两个J原子和两个氢原子构成,甲的电子式是
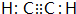 .
.(3)一定条件下,R元素的最高价氧化物乙在固定容积的密闭容器中发生分解反应(△H>0),达到平衡后,仅改变下表中反应条件x,该平衡体系中随x递增,y递减的是ac(选填序号)
| 选项 | a | b | c | d |
| x | 温度 | 温度 | 加入氧气 | 加入乙的物质 |
| y | 乙的物质的量 | 平衡常数K | 乙的转化率 | 生成物物质的量总和 |
(5)在298K下,J、M的单质各1mol完全燃烧,分别放出热量以akJ和bkJ时.又知一定条件下,M的单质能将J从它的最高价氧化物中置换出来,写出此置换反应的热化学方程式:4Al(s)+3CO2(g)=3C(s)+2Al2O3(s)△H=(+3a-4b)kJ/mol.(注:题中所设单质均为最稳定单质)
(6)用M单质作阳极,J单质作阴极,Ca(HCO3)2溶液作电解液,进行电解,阴极生成的气体和沉淀分别是H2、CaCO3,阳极也生成气体和沉淀,写出阳极的电极反应式Al-3e-+3HCO3-=Al(OH)3+3CO2↑.
19.由两种原子组成的纯净物( )
| A. | 一定是化合物 | B. | 可能是化合物,也可能是单质 | ||
| C. | 一定是单质 | D. | 一定是同素异形体 |
9.四种短周期元素在周期表中的位置如图,其中只有M为金属元素,下列说法不正确的是( )
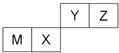

| A. | 原子半径Z<M | |
| B. | Z位于元素周期表中第2周期、第ⅥA族 | |
| C. | X的最简单气态氢化物的热稳定性比Z的小 | |
| D. | X的最高价氧化物不溶于任何酸 |
12.某学习小组研究同周期元素性质递变规律时,设计并进行了下列实验(表中的“实验步骤”与“实验现象”前后不一定是对应关系).
(1)请将各实验步骤对应的实验现象填写入下表中:
(2)此实验可得出的结论是:
Na、Mg、Al金属性强弱关系:Na>Mg>Al,Cl、S非金属性强弱关系:Cl>S.
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②向新制得的Na2S溶液中滴加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体. |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀. |
| 实验步骤 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A~F) | C | D |
Na、Mg、Al金属性强弱关系:Na>Mg>Al,Cl、S非金属性强弱关系:Cl>S.