题目内容
14.1.5molH2O中含有3mol H,共9.03×1023个O.分析 每个水分子含有2个H原子、1个O原子,H原子物质的量为水的2倍,氧原子物质的量等于水的物质的量,根据N=nNA计算氧原子数目.
解答 解:每个水分子含有2个H原子、1个O原子,1.5molH2O中含有H原子物质的量为1.5mol×2=3mol,含有O原子数目为1.51mol×6.02×1023mol-1=9.03×1023,
故答案为:3;9.03×1023.
点评 本题考查物质的量有关计算,比较基础,旨在考查学生对基础知识的掌握.

练习册系列答案
相关题目
5.实验室有一瓶腐蚀印刷线路板后的溶液,可能含有FeCl3、FeCl2、CuCl2中的一种或多种.下列根据实验事实得出的结论正确的是( )
| A. | 取一定量溶液,加入氯水和KSCN溶液,溶液变红说明溶液中含有FeCl2 | |
| B. | 取一定量溶液,加入少量铁粉,铁粉溶解说明溶液中含有FeCl3 | |
| C. | 取一定量溶液,加入足量铁粉充分反应后,溶液质量没有发生变化,说明溶液中含有FeCl3、FeCl2、CuCl2;若该溶液中含CuCl2为0.2mol,则含有FeCl3为0.7mol | |
| D. | 若该溶液是用含FeCl30.1mol溶液腐蚀印刷线路板后的溶液,则该溶液中有3n(FeCl3)+2 n(FeCl2)+2n(CuCl2)=0.3 |
9.H2SO4的摩尔质量为( )
| A. | 96g | B. | 96g/mol | C. | 98g | D. | 98g/mol |
19.食醋(主要成分CH3COOH )、纯碱(Na2CO3 )和小苏打(NaHCO3 )均为家庭厨房中常用的物质.已知:
请回答下列问题:
(1)定温度下,向0.1mol.L-1CH3COOH 溶液中加入少量CH3COONa 晶体时,下列说法正确的是ad(填代号).
a.溶液的pH增大 b. CH3COOH的电离程度增大
c.溶液的导电能力减弱 d.溶液中c(OH- )•c(H+ )不变
(2)25℃时,0.10mol.L-1 Na2CO3 溶液的pH=11,则溶液中由水电离出的c(OH- ):10-3mol.L-1
(3)常温下,将20mL 0.10mol.L-1 CH3COOH溶液和20mL 0.10mol.L-1 HNO2 溶液分别与20mL 0.10mol.L-1 NaHCO3 溶液混合(混合后溶液体积变化忽略不计).
①反应开始时,v(CH3COOH )< v(HNO2)(填“>”、“<”或“:”),原因是据其电离平衡常数可知,HNO2的酸性比醋酸强,醋酸的酸性比碳酸强,相同物质的量浓度的醋酸和HNO2相比,HNO2溶液中氢离子浓度大,所以与碳酸氢钠溶液反应速率快.
②充分反应后.两溶液中c(CH3COO-)<c(NO2-)(填“>”、“<”或“=”).
(4)25℃时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=18.
| 弱酸 | CH3COOH | H2CO3 | HNO2 |
| 电离常数(25℃) | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K=5.0×10-4 |
(1)定温度下,向0.1mol.L-1CH3COOH 溶液中加入少量CH3COONa 晶体时,下列说法正确的是ad(填代号).
a.溶液的pH增大 b. CH3COOH的电离程度增大
c.溶液的导电能力减弱 d.溶液中c(OH- )•c(H+ )不变
(2)25℃时,0.10mol.L-1 Na2CO3 溶液的pH=11,则溶液中由水电离出的c(OH- ):10-3mol.L-1
(3)常温下,将20mL 0.10mol.L-1 CH3COOH溶液和20mL 0.10mol.L-1 HNO2 溶液分别与20mL 0.10mol.L-1 NaHCO3 溶液混合(混合后溶液体积变化忽略不计).
①反应开始时,v(CH3COOH )< v(HNO2)(填“>”、“<”或“:”),原因是据其电离平衡常数可知,HNO2的酸性比醋酸强,醋酸的酸性比碳酸强,相同物质的量浓度的醋酸和HNO2相比,HNO2溶液中氢离子浓度大,所以与碳酸氢钠溶液反应速率快.
②充分反应后.两溶液中c(CH3COO-)<c(NO2-)(填“>”、“<”或“=”).
(4)25℃时,向CH3COOH溶液中加入一定量的NaHCO3,所得混合液的pH=6,则混合液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$=18.
6.固体碘化铵置于密闭容器中,加热至一定温度后恒温;容器中发生反应:
①NH4I(s)?NH3(g)+HI(g)
②2HI(g)?H2(g)+I2(g),
平衡时,测得总压为5.0kPa,其中H2的分压为0.5kPa,则下列说法中正确的是( )
①NH4I(s)?NH3(g)+HI(g)
②2HI(g)?H2(g)+I2(g),
平衡时,测得总压为5.0kPa,其中H2的分压为0.5kPa,则下列说法中正确的是( )
| A. | 固体碘化铵一定完全分解 | |
| B. | 若开始放入固体NH4I的量增大一倍,则平衡总压也会增大一倍 | |
| C. | 平衡时HI分解率为40% | |
| D. | 平衡时NH3的分压为2.5kPa |
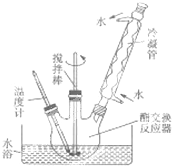 生物柴油是高级脂肪酸甲酯,可由油脂与甲醇通过取代反应(酯交换,生成新酯和新醇)得到,用菜籽油制备生物柴油的步骤如下:
生物柴油是高级脂肪酸甲酯,可由油脂与甲醇通过取代反应(酯交换,生成新酯和新醇)得到,用菜籽油制备生物柴油的步骤如下: