题目内容
下列叙述中,正确的是
- A.1.00L 1.00 mol?L-1盐酸中含有6.02×1023个HCl分子
- B.1.00L 1.00 mol?L-1 Na2CO3溶液中,CO2-3所带电荷总数为2×6.02×1023
- C.78.0g Na2O2与水完全反应,产生11.2L氧气(标准状况)、转移6.02×1023个电子
- D.配制1.00L 1.00 mol?L-1的CuSO4溶液,可将250.0 g CuSO4?5H2O溶于1.00 L水中
C
分析:A.HCl是强电解质,在溶液中完全电离为氢离子与氯离子;
B.溶液中CO32-水解,其离子浓度小于1mol/L,根据n=cV、N=nNA进行判断;
C.根据n= 计算78.0gNa2O2的物质的量,根据方程式计算生成氧气的物质的量,再根据V=nVm计算体积.根据氧气的物质的量计算转移电子数目;
计算78.0gNa2O2的物质的量,根据方程式计算生成氧气的物质的量,再根据V=nVm计算体积.根据氧气的物质的量计算转移电子数目;
D.将250.0 g CuSO4?5H2O溶于水配成1.00 L溶液,所得CuSO4溶液的浓度为1mol/L.
解答:A.HCl是强电解质,在溶液中完全电离为氢离子与氯离子,溶液中不存在HCl分子,故A错误;
B.溶液中CO32-水解,其离子浓度小于1mol/L,CO32-的物质的量小于1mol/L×1L=1mol,故CO32-所带电荷小于1mol×2×6.02×1023mol-1=2×6.02×1023,故B错误;
C.78.0gNa2O2的物质的量为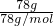 =1mol,根据方程式2Na2O2+2H2O=4NaOH+O2↑可知,生成氧气的物质的量为1mol×
=1mol,根据方程式2Na2O2+2H2O=4NaOH+O2↑可知,生成氧气的物质的量为1mol× =0.5mol,标况下氧气的体积为0.5mol×22.4L/mol=11.2L,反应中氧气为氧化产物,氧元素化合价由-1价升高为0价,故转移电子数目为0.5mol×2×6.02×1023mol-1=6.02×1023,故C正确;
=0.5mol,标况下氧气的体积为0.5mol×22.4L/mol=11.2L,反应中氧气为氧化产物,氧元素化合价由-1价升高为0价,故转移电子数目为0.5mol×2×6.02×1023mol-1=6.02×1023,故C正确;
D.250.0 g CuSO4?5H2O的物质的量为 =1mol,溶于水配成1.00 L溶液,所得CuSO4溶液的浓度为1mol/L,体积1L为溶液的体积,不是溶剂的体积,故D错误;
=1mol,溶于水配成1.00 L溶液,所得CuSO4溶液的浓度为1mol/L,体积1L为溶液的体积,不是溶剂的体积,故D错误;
故选C.
点评:本题考查常用化学计量的有关计算等,难度不大,注意A选项中不存在电解质分子.
分析:A.HCl是强电解质,在溶液中完全电离为氢离子与氯离子;
B.溶液中CO32-水解,其离子浓度小于1mol/L,根据n=cV、N=nNA进行判断;
C.根据n=
 计算78.0gNa2O2的物质的量,根据方程式计算生成氧气的物质的量,再根据V=nVm计算体积.根据氧气的物质的量计算转移电子数目;
计算78.0gNa2O2的物质的量,根据方程式计算生成氧气的物质的量,再根据V=nVm计算体积.根据氧气的物质的量计算转移电子数目;D.将250.0 g CuSO4?5H2O溶于水配成1.00 L溶液,所得CuSO4溶液的浓度为1mol/L.
解答:A.HCl是强电解质,在溶液中完全电离为氢离子与氯离子,溶液中不存在HCl分子,故A错误;
B.溶液中CO32-水解,其离子浓度小于1mol/L,CO32-的物质的量小于1mol/L×1L=1mol,故CO32-所带电荷小于1mol×2×6.02×1023mol-1=2×6.02×1023,故B错误;
C.78.0gNa2O2的物质的量为
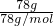 =1mol,根据方程式2Na2O2+2H2O=4NaOH+O2↑可知,生成氧气的物质的量为1mol×
=1mol,根据方程式2Na2O2+2H2O=4NaOH+O2↑可知,生成氧气的物质的量为1mol× =0.5mol,标况下氧气的体积为0.5mol×22.4L/mol=11.2L,反应中氧气为氧化产物,氧元素化合价由-1价升高为0价,故转移电子数目为0.5mol×2×6.02×1023mol-1=6.02×1023,故C正确;
=0.5mol,标况下氧气的体积为0.5mol×22.4L/mol=11.2L,反应中氧气为氧化产物,氧元素化合价由-1价升高为0价,故转移电子数目为0.5mol×2×6.02×1023mol-1=6.02×1023,故C正确;D.250.0 g CuSO4?5H2O的物质的量为
 =1mol,溶于水配成1.00 L溶液,所得CuSO4溶液的浓度为1mol/L,体积1L为溶液的体积,不是溶剂的体积,故D错误;
=1mol,溶于水配成1.00 L溶液,所得CuSO4溶液的浓度为1mol/L,体积1L为溶液的体积,不是溶剂的体积,故D错误;故选C.
点评:本题考查常用化学计量的有关计算等,难度不大,注意A选项中不存在电解质分子.

练习册系列答案
相关题目
下列叙述中不正确的是( )
| A、第ⅠA族的金属元素是同一周期中金属性最强的元素 | B、P、S、Cl得电子能力和最高价氧化物对应水化物的酸性均依次增强 | C、元素周期表中位于金属和非金属分界线附近的元素属于过渡元素 | D、主族元素原子的最外层电子数不一定等于该元素的最高化合价 |
 如右图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol?L-1,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑溶液体积的变化,则下列叙述中不正确的是( )
如右图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol?L-1,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑溶液体积的变化,则下列叙述中不正确的是( )