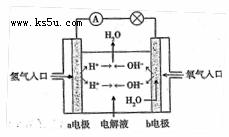
题目内容
下列两个反应均为在溶液中进行的反应,试按下列要求作答:①用双线桥标明下列反应中电子的转移及数目;
②在表格中填出反应式中的氧化剂、还原剂,氧化产物、还原产物.
③将其改写成离子方程式;
(1)2FeCl3+H2S═2FeCl2+S↓+2HCl
| 氧化剂: | 还原剂: | ||
| 氧化产物: | 还原产物: |
(2)MnO2+4HCl(浓)
 MnCl2+2H2O+Cl2↑
MnCl2+2H2O+Cl2↑| 氧化剂: | 还原剂: | ||
| 氧化产物: | 还原产物: |
【答案】分析:根据得失电子的元素和氧化还原反应中转移的电子数目来用双线桥标明下列反应中电子的转移及数目;
根据反应物中含元素化合价升高的物质为还原剂,含元素化合价降低的物质为氧化剂,还原剂对应的产物为氧化产物,氧化剂对应的产物为还原产物;
将化学反应改为离子反应时,弱电解质、单质、金属氧化物、气体、水等应保留化学式,强电解质应写成离子的形式.
解答:解:(1)反应2FeCl3+H2S═2FeCl2+S↓+2HCl中,Fe元素的化合价由+3价降低为+2价,得电子数为2×e-,S元素的化合价由-2价升高到0,
失去电子数为2e-,用双线桥标明下列反应中电子的转移及数目为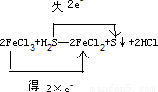 ,
,
该反应中的氧化剂为FeCl3,还原剂为H2S,氧化产物为S,还原产物为FeCl2,
该反应改为离子反应时,H2S、S应保留化学式,则离子方程式为2Fe3++H2S=2Fe2++S↓+2H+,
故答案为: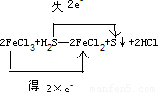 ;FeCl3;H2S;S;FeCl2;2Fe3++H2S=2Fe2++S↓+2H+;
;FeCl3;H2S;S;FeCl2;2Fe3++H2S=2Fe2++S↓+2H+;
(2)反应MnO2+4HCl(浓) MnCl2+2H2O+Cl2↑中,Mn元素的化合价由+4价降低为+2价,MnO2为氧化剂,得2e-,Cl元素由-1价升高到0,HCl为还原剂,失2×e-,
MnCl2+2H2O+Cl2↑中,Mn元素的化合价由+4价降低为+2价,MnO2为氧化剂,得2e-,Cl元素由-1价升高到0,HCl为还原剂,失2×e-,
用双线桥标明下列反应中电子的转移及数目为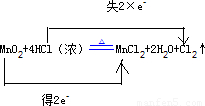 ,
,
氧化剂被还原,则还原产物为MnCl2,还原剂被氧化,则氧化产物为Cl2,
该反应改为离子反应时,MnO2、Cl2、H2O应保留化学式,则离子反应为MnO2+4H ++2Cl- Mn2++Cl2↑+2H2O,
Mn2++Cl2↑+2H2O,
故答案为: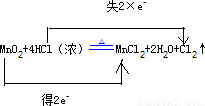 ;MnO2;HCl;Cl2;MnCl2;MnO2+4H ++2Cl-
;MnO2;HCl;Cl2;MnCl2;MnO2+4H ++2Cl-  Mn2++Cl2↑+2H2O.
Mn2++Cl2↑+2H2O.
点评:本题考查氧化还原反应,明确元素的化合价及变化,得失电子的元素及离子方程式的书写方法即可解答,难度不大.
根据反应物中含元素化合价升高的物质为还原剂,含元素化合价降低的物质为氧化剂,还原剂对应的产物为氧化产物,氧化剂对应的产物为还原产物;
将化学反应改为离子反应时,弱电解质、单质、金属氧化物、气体、水等应保留化学式,强电解质应写成离子的形式.
解答:解:(1)反应2FeCl3+H2S═2FeCl2+S↓+2HCl中,Fe元素的化合价由+3价降低为+2价,得电子数为2×e-,S元素的化合价由-2价升高到0,
失去电子数为2e-,用双线桥标明下列反应中电子的转移及数目为
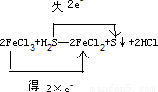 ,
,该反应中的氧化剂为FeCl3,还原剂为H2S,氧化产物为S,还原产物为FeCl2,
该反应改为离子反应时,H2S、S应保留化学式,则离子方程式为2Fe3++H2S=2Fe2++S↓+2H+,
故答案为:
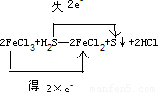 ;FeCl3;H2S;S;FeCl2;2Fe3++H2S=2Fe2++S↓+2H+;
;FeCl3;H2S;S;FeCl2;2Fe3++H2S=2Fe2++S↓+2H+;(2)反应MnO2+4HCl(浓)
 MnCl2+2H2O+Cl2↑中,Mn元素的化合价由+4价降低为+2价,MnO2为氧化剂,得2e-,Cl元素由-1价升高到0,HCl为还原剂,失2×e-,
MnCl2+2H2O+Cl2↑中,Mn元素的化合价由+4价降低为+2价,MnO2为氧化剂,得2e-,Cl元素由-1价升高到0,HCl为还原剂,失2×e-,用双线桥标明下列反应中电子的转移及数目为
 ,
,氧化剂被还原,则还原产物为MnCl2,还原剂被氧化,则氧化产物为Cl2,
该反应改为离子反应时,MnO2、Cl2、H2O应保留化学式,则离子反应为MnO2+4H ++2Cl-
 Mn2++Cl2↑+2H2O,
Mn2++Cl2↑+2H2O,故答案为:
 ;MnO2;HCl;Cl2;MnCl2;MnO2+4H ++2Cl-
;MnO2;HCl;Cl2;MnCl2;MnO2+4H ++2Cl-  Mn2++Cl2↑+2H2O.
Mn2++Cl2↑+2H2O.点评:本题考查氧化还原反应,明确元素的化合价及变化,得失电子的元素及离子方程式的书写方法即可解答,难度不大.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案
相关题目
| |||||||||||||||||||||||||||||||||

 Cd+2NiO(OH)+2H2O
Cd+2NiO(OH)+2H2O