��Ŀ����
����Ŀ��ͼ��X��Y��ZΪ���ʣ�����Ϊ���������֮���������ת����ϵ�����ֲ�������ȥ�������У�A�׳ƴ�����������E�Dz�����ˮ�������������������ᷴӦ���ش��������⣺ 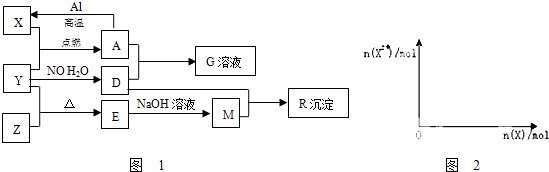
��1��M�д��ڵĻ�ѧ������Ϊ��
��2��һ�������£�Z��H2��Ӧת��ΪZH4 �� ZH4�ĵ���ʽΪ��
��3����֪A��1molAl��Ӧת��ΪXʱ���������ʾ�Ϊ���壩����ЧӦΪakJ����÷�Ӧ���Ȼ�ѧ����ʽΪ��
��4��A�����D��ϡ��Һ��Ӧ����G�����ӷ���ʽΪ��
��5����4molD��ϡ��Һ�У�����X��ĩ���������������ɵ�����ֻ��һ�֣���������ϵͼ���л���n��X2+����n��X���仯��ʾ��ͼ�������n��X2+�������ֵ��
���𰸡�
��1�����Ӽ������ۼ�
��2��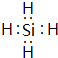
��3��8Al��s��+3Fe3O4��s��=9Fe��s��+4Al2O3��s����H=��8a kJ/mol
��4��3Fe3O4+28H++NO3��=9Fe3++NO��+14H2O
��5��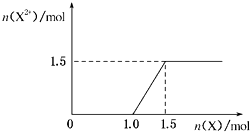
���������⣺A�׳ƴ�������������AΪFe3O4��E�Dz�����ˮ�������������������ᷴӦ����E��SiO2 �� ����ת����ϵ����֪XΪ����YΪO2��ZΪSi��DΪHNO3��MΪNa2SiO3��GΪFe��NO3��3 �� RΪH2SiO3 ��
��1.��MΪNa2SiO3 �� �������Ӽ������ۼ������Դ��ǣ����Ӽ������ۼ���
��2.��һ�������£�Si��H2��Ӧת��ΪSiH4 �� SiH4�ĵ���ʽΪ  �����Դ��ǣ�
�����Դ��ǣ�  ��
��
��3.��Fe3O4��1mol Al��Ӧת��ΪFeʱ���������ʾ�Ϊ���壩���ų�a kJ��������8molAl�μӷ�Ӧ�ų�������Ϊ8akJ�����Է�Ӧ���Ȼ�ѧ����ʽΪ��8Al��s��+3Fe3O4��s��=9Fe��s��+4Al2O3��s����H=��8a kJ/mol��
���Դ��ǣ�8Al��s��+3Fe3O4��s��=9Fe��s��+4Al2O3��s����H=��8a kJ/mol��
��4.�������������������ϡ���ᷴӦ������������NO��ˮ����Ӧ���ӷ���ʽΪ��3Fe3O4+28H++NO3��=9Fe3++NO��+14H2O��
���Դ��ǣ�3Fe3O4+28H++NO3��=9Fe3++NO��+14H2O��
��5.������ϡ���ᷴӦ����ʼ��ȫ������������Ϊ���������ʿ�ʼ��Fe2+����Ϊ0���������ļ��룬��������ֺ�Fe3+��Ӧ������Fe2+ �� ��Fe2+����������ֱ�������ֵ���Ժ䣬��Ӧ���������ɵ�����ΪNO����Fe2+��������ʵ���Ϊxmol�����ݵ���ת���غ��֪��NO�����ʵ���= ![]() ������NԪ���غ��֪��
������NԪ���غ��֪�� ![]() +2x mol=4 mol�����x=1.5�����ݵ���ת���غ��֪����Fe+2Fe3+=3Fe2+ �� ��֪��ʼ����NOʱFe�����ʵ�������Fe3+�����ʵ�������Ϊ1.5mol��
+2x mol=4 mol�����x=1.5�����ݵ���ת���غ��֪����Fe+2Fe3+=3Fe2+ �� ��֪��ʼ����NOʱFe�����ʵ�������Fe3+�����ʵ�������Ϊ1.5mol�� ![]() =1mol����n��Fe2+����n��Fe���仯��ʾ��ͼΪ��
=1mol����n��Fe2+����n��Fe���仯��ʾ��ͼΪ��  ��
��
���Դ��ǣ�  ��
��

����Ŀ��ij������ȤС�����ⶨijNaOH��Һ��Ũ�ȣ�������������£�
�ٽ���ʽ�ζ���������ˮϴ�����ô�����Һ��ϴ����ע�������Һ�����ڵζ��ܵļ��첿�ֳ�����Һ����ʹҺ�洦�ڡ�0���̶����µ�λ�ã����¶���������ƿ������ˮϴ�����ô�����Һ��ϴ��ƿ2��3�Σ��Ӽ�ʽ�ζ����з���25.00mL������Һ����ƿ�У�
�ڽ���ʽ�ζ���������ˮϴ�����ñ���Һ��ϴ��������ע��0.1000mol/L�����ᣬ���ڵζ��ܵļ��첿�ֳ�����Һ����ʹҺ�洦�ڡ�0���̶����µ�λ�ã����¶�����
������ƿ�е����̪��ָʾ�������еζ����ζ���ָʾ���պñ�ɫ���Ҳ������ϱ�ɫΪֹ�����������������ΪV1mL��
���ظ����Ϲ��̣����ڵζ�����������ƿ����5mL������ˮ�����������������ΪV2mL���Իش��������⣺
��1����ƿ�е���Һʱ���ﵽ�ζ��յ㣮
��2����С���ڲ�����еĴ�����
�ɴ���ɵIJⶨ�����ƫ�ߡ�ƫ�ͻ���Ӱ�죩
��3����ͼ����ij�εζ�ʱ�ĵζ����е�Һ�棬�����ΪMl 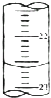
��4��������±����ݼ�������ռ���Һ��Ũ��mol/L��
�ζ����� | ����Һ�����mL�� | �����������mL�� | |
�ζ�ǰ������mL�� | �ζ��������mL�� | ||
��һ�� | 25.00 | 0.50 | 20.40 |
�ڶ��� | 25.00 | 4.00 | 24.10 |