题目内容
【题目】氨基甲酸铵(NH2COONH4)是重要的氨化剂,在潮湿的空气中能转化为碳酸铵,受热易分解、易被氧化。实验小组对氨基甲酸铵的性质进行了如下探究。请回答下列问题:
(1)氨基甲酸铵在潮湿的空气中转化为碳酸铵的化学方程式为____________________________。
(2)用下图装置探究氨基甲酸铵的分解产物(夹持装置略去,下同)。

①点燃A处的酒精灯之前,需先打开k,向装置中通入一段时间的N2,目的为_________________。
②仪器B的名称为_________________。
③装置D的作用为________________________________________________________。
④能证明分解产物中有NH3的现象为_________________________________________。
⑤试剂A用于检验分解产物中的CO2,该试剂的名称为_______________________。
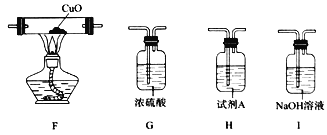
(3)已知:CuO高温能分解为Cu2O和O2。若用上述装置和下列部分装置进一步检验分解产物中是否有CO,装置E后应依次连接_________________(按从左到右的连接顺序填选项字母)。
(4)通过实验得出结论:氨基甲酸铵受热分解为NH3和CO2。该反应的化学方程式为_______________。
【答案】 NH2COONH4+H2O=(NH4)2CO3 排尽装置中空气,避免氨基甲酸铵与空气中的水蒸气和氧气反应 (球形)干燥管 吸收氨气,防止倒吸 C中湿润的红色石蕊试纸变蓝 澄清石灰水 IGFH NH2COONH4![]() 2NH3↑+CO2↑
2NH3↑+CO2↑
【解析】试题分析:(1)氨基甲酸铵与水反应生成碳酸铵;(2)氨基甲酸铵易被氧化,通入氮气排尽装置中空气;分解产物中含有氨气,D中倒置的漏斗可以防止倒吸;氨水呈碱性,氨气能使湿润的红色石蕊试纸变蓝;用澄清石灰水检验CO2;(3)检验CO应先用氢氧化钠除去可能含有的CO2;再用浓硫酸干燥后还原氧化铜,再检验有CO2生成;
解析:(1)氨基甲酸铵与水反应生成碳酸铵,方程式是NH2COONH4+H2O=(NH4)2CO3;(2)① 氨基甲酸铵易被氧化,通入氮气排尽装置中空气,避免氨基甲酸铵与空气中的水蒸气和氧气反应;②仪器B的名称为干燥管;
③分解产物中含有氨气,D中倒置的漏斗可以防止倒吸,浓硫酸吸收氨气;④氨水呈碱性,C中湿润的红色石蕊试纸变蓝,证明有氨气生成;⑤用澄清石灰水检验CO2;(3)检验CO应先用氢氧化钠除去可能含有的CO2;再用浓硫酸干燥后还原氧化铜,再检验有CO2生成,仪器连接顺序是IGFH;(4)氨基甲酸铵受热分解为NH3和CO2的化学方程式为NH2COONH4![]() 2NH3↑+CO2↑。
2NH3↑+CO2↑。

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
