题目内容
已知某亚铁盐的化学式可表示为(NH4)a Feb(s04)c。取一定质量的该亚铁盐样品全部溶于足量的水中,将所得溶液平均分为两份。一份溶液中加入足量的BaCl2溶液,得到白色沉淀9.32 g。另一份溶液同足量的浓NaOH溶液共热,产生的氨气用100 mL 0.5mo1·L-1稀硫酸吸收后(设产生的氨全部逸出),剩余的硫酸再用1.5 mol·L-1NaOH溶液中和,需NaOH溶液40mL。该亚铁盐样品中b:c的比值为
| A.1:1 | B.2:1 | C.1:2 | D.3:2 |
C
解析试题分析:题干中“溶液平均分为两份”在特别注意,一份溶液中加入足量的BaCl2溶液,得到白色沉淀9.32 g,可以算出S04的物质的量是:9.32g/233g·mol-1~="0.04" mol;根据另一份溶液中发生的一系列反应,可知NH4物质的量是:
2NH4 ~ 2NH3 ~ H2SO4
2mol 1mol
n 0.5×0.1-1/2(1.5×0.04)mol
n=0.04mol
再根据电荷守恒: a+2b=2c a=0.04,c="0.04" mol b="0.02" mol
b:c=1:2
考点:考查化学方程式计算的知识。

 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案向三份同浓度的25mL盐酸中分别加入质量不等的NaHCO3、KHCO3的混合物,测得产生
气体的体积如下表所示(不考虑气体溶解)
| 编号 | 1 | 2 | 3 |
| m(混合物)/g | 4.6 | 7.2 | 7.9 |
| V(CO2)(标准状况)/L | 1.12 | 1.68 | 1.68 |
下列分析推理正确的是
A.根据实验1中的数据可以计算出盐酸的浓度
B.混合物中NaHCO3的质量分数约为45.7%
C.根据第2、3组数据可以分析出第2组中的混合物完全反应
D.盐酸的物质的量浓度为1.5mol.L-1
向50 mL NaOH溶液中逐渐通入一定量的CO2(假设溶液体积不变),随后取此溶液10 mL,将其稀释至100 mL,并向此稀释后的溶液中逐滴加入0.1 mol·L-1的盐酸,产生CO2气体的体积(标准状况下)与所加入的盐酸的体积关系如图,下列分析错误的是( )
| A.OA段所发生反应的离子方程式: H++OH-=H2O;CO32-+H+=HCO3- |
| B.NaOH在吸收CO2后,所得溶液的溶质为NaOH和Na2CO3,其物质的量浓度之比为1∶1。 |
| C.产生的CO2体积(标准状况下)为0.056 L |
| D.原NaOH溶液的物质的量浓度为0.5 mol·L-1 |
下列溶液中c(Cl-)与50 mL 1 mol/LAlCl3溶液中c(Cl-)相等的是
| A.150 mL 1 mol/L的NaCl溶液 | B.75 mL 2 mol/L的NH4Cl溶液 |
| C.150 mL 2 mol/L的KCl溶液 | D.75 mL 1 mol/L的FeCl3溶液 |
设NA为阿伏加德罗常数的数值,下列说法正确的是
| A.常温下,23 g NO2含有NA个氧原子 |
| B.1molFe与过量的稀HNO3反应,转移2 NA个电子 |
| C.1mol/L NaCl溶液含有NA个Na+ |
| D.常温常压下,22.4 L的NO2和CO2混合气体含有2 NA个O原子 |
设NA为阿伏加德罗常数的值。下列叙述正确的是
| A.1 L 1.0 mol/L的NH4Al(SO4)2溶液中含有的氧原子数为8NA |
| B.25℃时pH=13的NaOH溶液中含有OH-的数目为0.1NA |
| C.标准状况下,2.24 L CO和CO2混合气体中含有的碳原子数目为0.1NA |
| D.1 mol FeCl3完全水解得到的Fe(OH)3胶体中含有的胶粒的数目为1NA |
下列关于物质的量、摩尔质量的叙述中正确的是( )
| A.0.012 kg12C中含有约6.02×1023个碳原子 |
| B.1 mol H2O中含有2 mol氢和1 mol氧 |
| C.氢氧化钠的摩尔质量是40 g |
| D.2 mol水的摩尔质量是1 mol水的摩尔质量的2倍 |
以NA表示阿伏伽德罗常数,下列说法正确的是
| A.分子总数为NA的NO2和CO2混合气体含有的氧原子数为2NA |
| B.标准状况下,由Na2O2制的11.2LO2反应转移的电子束为2NA |
| C.18.0g重水(D2O)与20gNe所含有的电子数都为10NA |
| D.0.5mol O3与11.2L O2所含的分子数都为0.5NA |
下列化学用语表述正确的是( )
A.“84消毒液”中有效成分NaClO的电子式: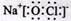 |
B.食盐中阴离子的核外电子排布式: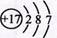 |
C.聚丙烯的结构简式: |
| D.乙烯的结构简式:CH2CH2 |