题目内容
【题目】下列离子方程式中,正确的是( )
A. 硫酸镁与氯化钡溶液的反应:MgSO4+Ba2+![]() Mg2++ BaSO4↓
Mg2++ BaSO4↓
B. 铁与稀硫酸反应:2Fe+6H+![]() 2Fe3++3H2↑
2Fe3++3H2↑
C. NH4HCO3溶于过量的NaOH溶液中:HCO+OH-===CO![]() +H2O
+H2O
D. 向Fe(NO3)2稀溶液中加入盐酸:3Fe2++4H++NO3-===3Fe3++NO↑+2H2O
【答案】D
【解析】A. 硫酸镁与氯化钡溶液的反应:MgSO4是强电解质,SO42-+Ba2+![]() BaSO4↓,选项A错误;B. 铁与稀硫酸反应的离子方程式为:Fe+2H+
BaSO4↓,选项A错误;B. 铁与稀硫酸反应的离子方程式为:Fe+2H+![]() Fe2++H2↑,选项B错误;C. NH4HCO3溶于过量的NaOH溶液中:NH4++HCO+2OH-= NH3H2O+CO
Fe2++H2↑,选项B错误;C. NH4HCO3溶于过量的NaOH溶液中:NH4++HCO+2OH-= NH3H2O+CO![]() +H2O,选项C错误;D. 向Fe(NO3)2稀溶液中加入盐酸,反应的离子方程式为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,选项D正确。答案选D。
+H2O,选项C错误;D. 向Fe(NO3)2稀溶液中加入盐酸,反应的离子方程式为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O,选项D正确。答案选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某学习小组通过下列装置探究MnO2与FeCl3·6H2O能否反应产生Cl2。
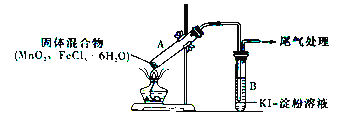
实验操作和现象如下表所示:
实验编号 | 操作 | 现象 |
实验1 | 按上图所示装置加热MnO2与FeCl3·6H2O混合物 | ①试管A中部分固体溶解,上方出现白雾 ②稍后,产生黄色气体,管壁附着黄色液滴 ③试管B中溶液变蓝 |
实验2 | 把试管A中的混合物换为FeCl3·6H2O,试管B中溶液换为KSCN溶液,加热 | 试管A中部分固体溶解,产生白雾和黄色气体;试管B中KSCN溶液变红 |
请回答下列问题:
(1)实验1和实验2 产生白雾的原因是_____________________________。
(2)实验2说明黄色气体中含有_____________(填化学式)。
(3)为进一步确认黄色气体中是否含有Cl2,该学习小组对实验1提出两种改进方案:
方案1:在试管A、B间增加盛有某种试剂的洗气瓶C,结果试管B 中溶液仍变为蓝色。
方案2:将试管B中KI-淀粉溶液替换为NaBr溶液,结果试管B 中溶液呈橙红色,且未检出Fe2+。则方案1中洗气瓶C 中盛放的试剂是_________;方案2 中检验Fe2+的试剂的名称是______,选择NaBr溶液后试管B中发生的主要反应的离子方程式为______________________________________。
(4)实验1充分加热后,若将试管A中产物分离得到Fe2O3 和MnCl2,则试管A 中产生Cl2 的化学方程式为__________________________________________。其尾气处理的方法是_______________________。
(5)该学习小组认为实验1中溶液变蓝,可能还有另外一种原因是__________________。请你设计实验方案验证此猜想_______________________________________________。