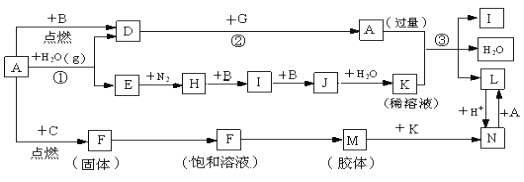
题目内容
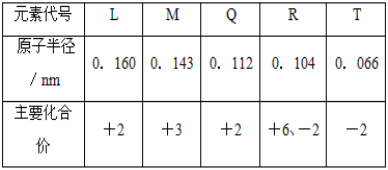
【题目】根据表中![]() 部分短周期元素的原子半径及主要化合价
部分短周期元素的原子半径及主要化合价![]() 信息,判断以下叙述正确的是
信息,判断以下叙述正确的是
A.氢化物的沸点为![]()
B.L和Q的最高价氧化物对应的水化物的碱性![]()
C.M与T形成的化合物具有两性
D.![]() 与
与![]() 的核外电子数相等
的核外电子数相等
【答案】C
【解析】
T只显-2价,T是O元素;R显+6、-2价,R是S元素,L、M分别显+2、+3价,且半径大于S,所以L、M分别是Mg、Al;Q为+2价,半径小于Mg,Q是Be元素。
A.水分子间形成氢键,氢化物的沸点为 H2O>H2S,故A错误;
B.同主族元素从上到下金属性增强,金属性Mg>Be,Mg和Be的最高价氧化物对应的水化物的碱性 Mg(OH)2>Be(OH)2,故B错误;
C.Al与O形成的化合物是Al2O3,Al2O3是两性氧化物,故C正确;
D. Mg2+核外有10个电子, S2-核外有18个电子,故D错误;
选C。

练习册系列答案
相关题目