题目内容
下列溶液中微粒浓度关系一定正确的是
| A.将pH=5的H2SO4溶液稀释1×103后,c(H+):c(SO42-)=2:1 |
B.醋酸与醋酸钠的 的混合溶液中:c(CH3COO-)+c(CH3COOH)<c(Na+) 的混合溶液中:c(CH3COO-)+c(CH3COOH)<c(Na+) |
C.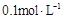 的硫酸铵溶液中:c(NH4+)+c(H+)>c(SO42-)+c(OH-) 的硫酸铵溶液中:c(NH4+)+c(H+)>c(SO42-)+c(OH-) |
| D.常温下pH=4的NaHC2O4溶液中:c(H2C2O4)<c(C2O42-) |
CD
试题分析:将pH=5的H2SO4溶液稀释1×103 属于无限稀释,溶液接近中性,此时水的电离不能忽略,所以c(H+):c(SO42-)=2:1不成立,A错误;醋酸与醋酸钠的混合溶液
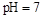 ,则c(H+)= c(OH-),所以必有 c(Na+)=c(CH3COO-),B错误;
,则c(H+)= c(OH-),所以必有 c(Na+)=c(CH3COO-),B错误;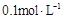 的硫酸铵溶液有电荷守恒式c(NH4+)+c(H+)=2c(SO42-)+c(OH-),所以c(NH4+)+c(H+)>c(SO42-)+c(OH-)必成立,C正确; NaHC2O4溶液pH=4显酸性,说明HC2O4- 电离大于水解,所以水解产生的草酸浓度小于电离产生的草酸跟离子浓度,D正确;故选CD。
的硫酸铵溶液有电荷守恒式c(NH4+)+c(H+)=2c(SO42-)+c(OH-),所以c(NH4+)+c(H+)>c(SO42-)+c(OH-)必成立,C正确; NaHC2O4溶液pH=4显酸性,说明HC2O4- 电离大于水解,所以水解产生的草酸浓度小于电离产生的草酸跟离子浓度,D正确;故选CD。
练习册系列答案
相关题目
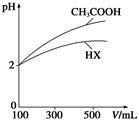



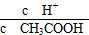 C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.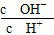
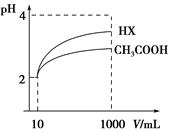
 不变
不变
 CH3COO-+H+ ΔH>0
CH3COO-+H+ ΔH>0