题目内容
某化学课外活动小组通过实验研究NO2的性质.
已知:2NO2+2NaOH═NaNO3+NaNO2+H2O
利用图1所示装置探究NO2能否被NH3还原(K1、K2为止水夹,夹持固定装置略去)
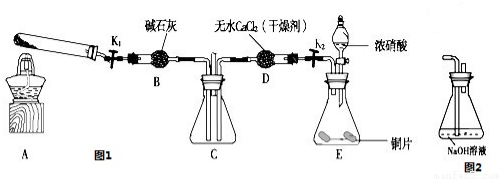
(1)E装置中制取NO2反应的离子方程式是
(2)该实验中制取氨气时若只用一种试剂,从下列物质中选取 ( )
a.NH4HCO3 b.NH4Cl c.浓氨水
(3)若NO2能够被NH3还原,预期观察到C装置中的现象是
(4)此实验装置存在一个明显的缺陷是
(5)探究NO2能否与Na2O2发生氧化还原反应.为了验证NO2能被Na2O2氧化,该小组同学选用B、D、E装置,将B中的药品更换为Na2O2,另选F装置(如图2所示),重新组装,进行实验.装置的合理连接顺序是
(6)实验过程中,B装置中淡黄色粉末逐 渐变成白色.经检验,该白色物质为纯净物,且无其他物质生成.推测B装置中反应的化学方程式为
(1) Cu+4H++2NO3-═Cu2++2NO2↑+2H2O (2) a (3)C装置中混合气体颜色变浅
(4)缺少尾气吸收装置 (5)EDBDF或EDBF或FDBDE或FBDE 2NO2+Na2O2═2NaNO3
【解析】
试题分析:(1)浓硝酸与Cu反应的离子方程式为:Cu+4H++2NO3-═Cu2++2NO2↑+2H2O 。(2)用一种固体物质加热制取NH3,要用a NH4HCO3分解的方法。NH4HCO3 NH3↑+H2O+ CO2↑.不能用加热NH4Cl的方法。因为:NH4Cl
NH3↑+H2O+ CO2↑.不能用加热NH4Cl的方法。因为:NH4Cl NH3↑+HCl↑。在试管口二者又重新化合生成NH4Cl。NH3+HCl =NH4Cl。最终得不到氨气。(3)若NO2能够被NH3还原,预期观察到C装置中的现象是由于消耗红棕色的NO2气体,使得C装置中混合气体颜色变浅。(4)由于NH3、NO2都是你大气污染物,所以此实验装置存在一个明显的缺陷是缺少尾气吸收装置。(5)探究NO2能否与Na2O2发生氧化还原反应,重新组装,进行实验.装置的合理连接顺序是EDBDF或EDBF或FDBDE或FBDE,(6)根据元素的原子个数守恒和电子守恒的知识,结合题干已知条件可推测B装置中反应的化学方程式为2NO2+Na2O2═2NaNO3。
NH3↑+HCl↑。在试管口二者又重新化合生成NH4Cl。NH3+HCl =NH4Cl。最终得不到氨气。(3)若NO2能够被NH3还原,预期观察到C装置中的现象是由于消耗红棕色的NO2气体,使得C装置中混合气体颜色变浅。(4)由于NH3、NO2都是你大气污染物,所以此实验装置存在一个明显的缺陷是缺少尾气吸收装置。(5)探究NO2能否与Na2O2发生氧化还原反应,重新组装,进行实验.装置的合理连接顺序是EDBDF或EDBF或FDBDE或FBDE,(6)根据元素的原子个数守恒和电子守恒的知识,结合题干已知条件可推测B装置中反应的化学方程式为2NO2+Na2O2═2NaNO3。
考点:考查NH3、NO2的实验室制法及NO2的化学性质的探究。
