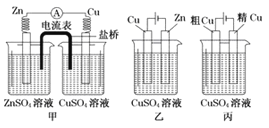
题目内容
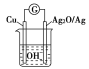
【题目】普通水泥在固化过程中自由水分子减少并形成碱性溶液。根据这个特点,科学家发明了测水泥初凝时间的某种方法。此法的原理如图所示,反应的总化学方程式为2Cu+Ag2O===Cu2O+2Ag,下列有关说法正确的是( )
A. 工业上以石灰石和石英为主要原料制造普通水泥
B. 测定原理示意图中,Ag2O为负极
C. 负极的电极反应式为2Cu+2OH--2e-===Cu2O+H2O
D. 电池工作时,OH-向正极移动
【答案】C
【解析】
由电池反应方程式2Cu+Ag2O=Cu2O+2Ag知,较活泼的金属铜失电子发生氧化反应,所以铜作负极,较不活泼的金属银作正极,原电池放电时,溶液中阳离子向正极移动,阴离子向负极移动;根据转移电子和氧化亚铜的关系计算转移电子数。
A.制造水泥的主要原料为粘土、石灰石等,没有石英,选项A错误;B.测量原理示意图中,电流方向从正极流向负极,即Ag2O→Cu,Ag2O为正极,选项B错误;C.负极发生氧化反应,电极方程式为2Cu+2OH--2e-=Cu2O+H2O,选项C正确;D.原电池工作时,阴离子向负极移动,阳离子向正极移动,选项D错误。答案选C。

【题目】大气中的部分碘源于![]() 对海水中
对海水中![]() 的氧化。其科学小组进行
的氧化。其科学小组进行![]() 与含
与含![]() 溶液反应的相关研究:
溶液反应的相关研究:
(1)![]() 将
将![]() 氧化生成
氧化生成![]() 的过程由3步反应组成:
的过程由3步反应组成:
①![]()
![]()
②![]()
![]()
③![]()
![]()
用热化学方程式表示![]() 氧化
氧化![]() 生成
生成![]() 的反应______。
的反应______。
(2)![]() 在水中易分解,一定条件下,
在水中易分解,一定条件下, ![]() 的浓度减少一半时所需的时间(t)如下表所示。已知:
的浓度减少一半时所需的时间(t)如下表所示。已知: ![]() 的起始浓度为
的起始浓度为![]()
pH t/min T/℃ | 3.0 | 4.0 | 5.0 | 6.0 |
20 | 301 | 231 | 169 | 58 |
30 | 158 | 108 | 48 | 15 |
50 | 31 | 26 | 15 | 7 |
①![]() 增大能加速
增大能加速![]() 分解,表明对
分解,表明对![]() 分解起催化作用的是___________。
分解起催化作用的是___________。
②根据表中数据,推测![]() 在下列条件下分解速率依次增大的顺序为__________(填字母代号)
在下列条件下分解速率依次增大的顺序为__________(填字母代号)
a. 40℃、![]() b. 10℃、
b. 10℃、![]() c. 30℃、
c. 30℃、![]()
(3)![]() 在KI溶液中存在下列平衡:
在KI溶液中存在下列平衡:![]() 。测得不同温度下该反应的平衡常数如图所示,下列说法正确的是__________。
。测得不同温度下该反应的平衡常数如图所示,下列说法正确的是__________。

A. 反应![]() 的
的![]()
B. 利用该反应可以除去硫粉中少量的碘单质
C. 在上述平衡体系中加入苯,平衡不移动
D. 25℃时,在上述平衡体系中加入少量![]() 固体,平衡常数K小于680
固体,平衡常数K小于680
(4)将![]() 溶于
溶于![]() 中,得到紫红色的溶液,再加入一定浓度的
中,得到紫红色的溶液,再加入一定浓度的![]() 溶液,现象如图所示:
溶液,现象如图所示:

①上层溶液中含碘元素的微粒有_______________(用化学符号表示)。
②由实验现象可推测关于![]() 溶解性的结论是______________。
溶解性的结论是______________。