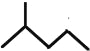
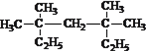题目内容
【题目】下列离子组合,能大量共存的是
A.酸性溶液中:Al3+、Fe3+、SO32-、Cl-
B.透明溶液中:MnO4-、K+、Na+、NO3-
C.强碱性溶液中:Na+、NO3-、SO32-、HCO3-
D.强酸性溶液中:Na+、Fe2+、SO42-、NO3-
【答案】B
【解析】
试题分析:A.酸性溶液中,SO32-与H+反应生成气体,不能大量共存;B.能大量共存;C.强碱性溶液中,HCO3-与OH-反应生成CO32-和水,不能大量共存;D.强酸性溶液中,Fe2+、NO3-发生氧化还原反应,不能大量共存;故选B。

 阅读快车系列答案
阅读快车系列答案【题目】A、B、C、D、E、F是元素周期表前四周期中原子序数依次增大的六种常见元素,其相关信息如下表:
元素 | 相 关 信 息 |
A | 原子核外有7种运动状态不同的电子 |
B | 外围电子排布式为nsnnpn+2 |
C | 常见的金属,在周期表中周期序数与族序数相等 |
D | 气态氢化物及最高价氧化物对应的水化物均为强酸 |
E | 一种核素的质量数为56,中子数为30 |
F | 单质紫红色,电缆材料,常见氧化物为黑色 |
回答下列问题:
(1)元素E在元素周期表中的位于第四周期第__族,其高价态离子核外有__个未成对电子
(2)B、C、D三种元素的离子半径由小到大的顺序是______(用离子符号表示).
(3)A、D两元素的简单氢化物发生反应生成的化合物的电子式为_______
(4)常温下AD3是一种淡黄色液体。以下关于AD3的说法中,正确的是__________
A.AD3分子中只有非极性键 B.AD3分子中各原子均达8e-稳定结构
C.AD3的晶体属于分子晶体 D.AD3液体气化时化学键被破坏
(5)金属C与E的黑色磁性晶体氧化物在高温下反应,该反应的化学方程式为___________________
(6)向F的硫酸盐溶液中通入AH3气体至过量,观察到的现象是__________;该过程总的离子反应式为________________向反应后的溶液中加入适量乙醇,析出深蓝色晶体,该晶体中不含有的化学键类型是________
A.配位键 B.极性共价键 C.非极性共价键 D.离子键
【题目】氨水和盐酸是常见的化学试剂,可将氨气(NH3)、氯化氢气体分别溶于水制得。
(1)氨气的发生装置可以选择下图中的_______,反应的化学方程式为__________________。
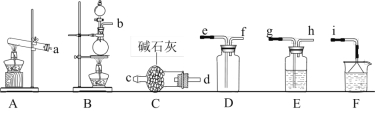
(2)欲收集一瓶干燥的氨气,选择上图中的装置,其连接顺序为:发生装置→_______(按气流方向,用小写字母表示)。
(3)小华为探究氨气溶于水是否发生化学反应,设计并完成如下实验(填写表中空白):
实验操作 | 实验现象及结论 |
将浸有酚酞溶液的滤纸干燥后,放入盛有干燥氨气的集气瓶中 | 无明显现象 |
(4)小明将滴有酚酞的稀氨水加热,观察到溶液颜色变浅,原因可能是 。
(5)小芳将滴有石蕊的稀盐酸加热,溶液颜色无明显变化。为进一步研究,取稀盐酸分成2份:①未经加热;②加热煮沸一段时间后冷却,分别中和等量的氢氧化钠,消耗二者的质量:①﹥②,则稀盐酸经加热煮沸后浓度 (填“增大”、“减小”或“不变”)。为除去氯化钠溶液中的碳酸钠,小林设计了如下方案:

你认为上述方案 (填“合理”或“不合理”),请分析: (如合理,说明原因;如不合理,说明原因并设计改进方案)。
(6)为研究氨气的还原性,小兰做了一下实验:将(2)收集到的NH3充入注射器X中,硬质玻璃管Y中加入少量催化剂,充入NO2(两端用夹子K1、K2夹好)。在一定温度下按图示装置进行实验。
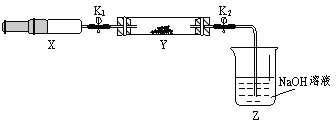
操作步骤 | 实验现象 | 解释原因 |
打开K1,推动注射器活塞,使X中的气体缓慢充入Y管中 | ①Y管中___________ | ②反应的化学方程式 ______________________ |
将注射器活塞退回原处并固定,待装置恢复到室温 | Y管中有少量水珠 | 生成的气态水凝聚 |
打开K2 | ③___________________ | ④____________________ |