题目内容
用水稀释0.1mol· L-1的醋酸溶液,下列说法正确的是( )
| A.醋酸的电离程度逐渐增大,溶液的PH值减小 |
| B.水的电离程度增大 |
| C.Kw逐渐减小 |
D. 变大 变大 |
B
解析试题分析:A.用水稀释0.1mol· L-1的醋酸溶液,醋酸的电离平衡CH3COOH  CH3COO-+H+正向移动,c(H+)、c(CH3COO-)都减小,醋酸的电离程度逐渐增大,溶液的PH值增大。错误。B。由于加水稀释,CH3COOH电离产生的c(H+)减小,对水电离的抑制作用减弱。所以c(OH-)增大,而OH-是水电离产生的,所以水的电离程度增大。正确。C.水的离子积常数Kw只与温度有关。温度不变,所以Kw不变。错误。D.在加水稀释的过程中,c(CH3COO-)减小,c(OH-)增大,所以
CH3COO-+H+正向移动,c(H+)、c(CH3COO-)都减小,醋酸的电离程度逐渐增大,溶液的PH值增大。错误。B。由于加水稀释,CH3COOH电离产生的c(H+)减小,对水电离的抑制作用减弱。所以c(OH-)增大,而OH-是水电离产生的,所以水的电离程度增大。正确。C.水的离子积常数Kw只与温度有关。温度不变,所以Kw不变。错误。D.在加水稀释的过程中,c(CH3COO-)减小,c(OH-)增大,所以 变小。
变小。
考点:考查弱电解质溶液在稀释过程中的物质的电离程度、水的电离、Kw及 的变化的知识。
的变化的知识。

练习册系列答案
相关题目
25℃时,某溶液中只含有Na+、H+、OH-、A-四种离子。下列说法正确的是 ( )
| A.对于该溶液一定存在:pH≥7 |
| B.若c(OH-)>c(H+),则溶液中不可能存在:c(Na+)>c(OH-)>c(A-)>c(H+) |
| C.若溶液中c(A-)= c(Na+),则溶液一定呈中性 |
| D.若溶质为NaA,则溶液中一定存在:c(Na+)>c(A-)>c(OH-)>c(H+) |
氯碱工业的产物NaOH与不同物质反应可以生成不同的盐。已知常温下,浓度均为
0.1 mol·L-1的4种钠盐溶液的pH如下表:
| 溶质 | Na2CO3 | NaHCO3 | NaClO | NaHSO3 |
| pH | 11.6 | 9.7 | 10.3 | 5.2 |
下列说法中正确的是( )
A.向氯水中加入NaHCO3溶液,可以增大氯水中次氯酸的浓度
B.四种溶液中,水的电离程度最大的是NaClO
C.常温下,相同物质的量浓度的H2SO3、H2CO3、HClO溶液,pH最大的是H2SO3溶液
D.NaHSO3溶液中离子浓度大小顺序为c(Na+)>c(H+)>c(HS
 )>c(S
)>c(S )>c(OH-)
)>c(OH-) 已知25℃时一些难溶物质的溶度积常数如下:
| 化学式 | Zn(OH)2 | ZnS | AgCl | Ag2S | MgCO3 | Mg(OH)2 |
| 溶度积 | 5×10-17 | 2.5×10-22 | 1.8×10-10 | 6.3×10-50 | 6.8×10-6 | 1.8×10-11 |
根据上表数据,判断下列化学方程式不正确的是( )
A.2AgCl+Na2S=2NaCl+Ag2S
B.MgCO3+H2O△,Mg(OH)2+CO2↑
C.ZnS+2H2O=Zn(OH)2+H2S↑
D.Mg(HCO3)2+2Ca(OH)2=Mg(OH)2↓+2CaCO3↓+2H2O
常温下,向盛有1 L 0.1 mol·L-1 NaHSO4溶液的烧杯中不断滴加0.05 mol·L-1的Ba(OH)2溶液,溶液中产生沉淀物质的量n(mol)与溶液pH的变化情况如下图所示,下列说法不正确的是
| A.A点时pH=1 |
| B.恰好完全沉淀时Ba(OH)2的体积为2 L |
C.B点时,溶液中的离子浓度关系为c(Na+)>c( )>c(H+)=c(OH-) )>c(H+)=c(OH-) |
| D.C点时pH=14 |
常温下pH最小的是下列各项中的( )
| A.pH=0的溶液 | B.0.04 mol·L-1H2SO4 |
| C.0.5 mol·L-1HCl | D.0.05 mol·L-1CH3COOH |
下列事实不能说明一元酸HA为弱酸的是( )
| A.常温下0.1 mol·L-1的HA溶液pH为5 |
| B.常温下NaA溶液的pH>7 |
| C.HA溶液中存在H+、OH-、A-、HA |
| D.HA溶液能与大理石反应 |
如图所示用一定浓度的NaOH溶液Y滴定10 mL一定物质的量浓度的盐酸X,依据图示推出X和Y的物质的量浓度是下列各组中的( )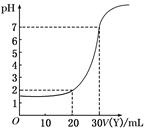
| | A | B | C | D |
| X物质的量浓度/mol·L-1 | 0.12 | 0.04 | 0.03 | 0.09 |
| Y物质的量浓度/mol·L-1 | 0.04 | 0.12 | 0.09 | 0.03 |
已知:25 ℃时,Ksp[Mg(OH)2]=5.61×10-12,Ksp(MgF2)=7.42×10-11。下列说法正确的是( )
| A.25 ℃时,饱和Mg(OH)2溶液与饱和MgF2溶液相比,前者的c(Mg2+)大 |
| B.25 ℃时,在Mg(OH)2的悬浊液加入少量的NH4Cl固体,c(Mg2+)增大 |
| C.25 ℃时,Mg(OH)2固体在20 mL 0.01 mol·L-1氨水中的Ksp比在20 mL 0.01 mol·L-1 NH4Cl溶液中的Ksp小 |
| D.25 ℃时,在Mg(OH)2的悬浊液加入NaF溶液后,Mg(OH)2不可能转化成为MgF2 |