题目内容
硬质玻璃管是化学实验中经常使用的一种仪器,请分析下列实验(固定装置略)并回答问题。
Ⅰ、进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表。请填写表中的空白:

|
棉球 |
棉球上滴加的试剂 |
实验现象 |
解释和结论 |
|
a |
|
棉球变白,微热后又恢复红色 |
|
|
b |
含酚酞的NaOH溶液 |
棉球变为白色 |
离子方程式:
|
|
c |
|
棉球变为白色 |
结论:该气体具有 性 |
Ⅱ、硬质玻璃管与其它装置结合完成定性或定量实验。下图是某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究的装置。

实验一:铁矿石中含氧量的测定
a.按上图组装仪器(夹持仪器均省略),检查装置的气密性;
b.将5.0g铁矿石放入硬质玻璃管中;
c.从左端导气管口处不断地缓缓通入H2, 后,点燃A处酒精灯;
d.充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(1)步骤c中填空
(2)测得反应后装置B增重1.35g,则铁矿石中氧的质量分数为______________________。实验二:铁矿石中含铁量的测定

(3)步骤④中煮沸的目的是_____________________________________________。
(4)步骤②和⑤中都要用到的玻璃仪器是______ __。
(5)下列有关步骤⑥的操作中说法不正确的是_______________________________。
a.滴定管用蒸馏水洗涤后再用待装液润洗
b.锥形瓶不需要用待测液润洗
c.因为碘水为黄色,所以滴定过程中不需加指示剂
实验结论:推算铁的氧化物的组成
(6)由实验一、二得出该铁矿石中铁的氧化物的化学式为____________________________。
Ⅰ(每空1分)
|
棉球 |
棉球上滴加的试剂 |
实验现象 |
解释和结论 |
|
a |
品红试液
|
|
|
|
b |
|
|
离子方程式: 2OHˉ+SO2=SO32ˉ+H2O |
|
c |
含淀粉的碘水
|
|
结论:该气体具有 还原 性 |
Ⅱ、(1)在C装置出口处收集H2并验纯后。(1分)(2)24%(2分)
(3)除去溶液中溶解的过量的Cl2(1分)(4)烧杯、玻璃棒(1分)(5)c(1分)(6)Fe5O6(2分)
【解析】
试题分析:Ⅰ.a、浓硫酸与亚硫酸钠反应生成SO2,SO2具有漂白性。品红试液是红色的,二氧化硫能使品红褪色,漂白原理是:SO2与品红反应生成无色不稳定物质,遇热分解又生成SO2和品红,又恢复红色。b、氢氧化钠遇到酚酞也是红色的,SO2是酸性氧化物,能和氢氧化钠反应是溶液碱性降低,导致红色消失,反应原理是:2OHˉ+SO2=SO32ˉ+H2O。c、碘单质遇到淀粉变为蓝色,二氧化硫具有还原性,能将碘单质还原为碘离子,SO2+I2+2H2O=H2SO4+2HI,从而使蓝色消失。
Ⅱ、氢气是可燃性气体,点燃前相应检验其纯度,所以在C装置出口处收集H2并验纯后再点燃A处酒精灯。
(2)该实验中,氢气和氧化铁反应生成金属铁和水,根据固体质量的变化来计算铁的含量,B处的干燥管作用是吸收产生的水蒸气,测的反应后装置B增重1.35g,即反应中生成水的质量是1.35g,物质的量=1.35g÷18g/mol=0.075mol,其中氧元素的质量=0.075mol×16g/mol=1.2g。所以根据氧原子守恒可知,铁矿石中氧的质量分数=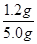 ×100%=24%。
×100%=24%。
(3)氯气具有强氧化性,能氧化碘离子,从而干铁离子与碘离子的反应,所以煮沸的作用是赶走溶液中溶解的过量的Cl2。
(4)②是过滤,需要烧杯、玻璃棒和铁架台。⑤是物质的量浓度的配制,需要的仪器是250ml容量瓶、烧杯、玻璃棒、胶头滴管,所以步骤②和⑤中都要用到的玻璃仪器是烧杯和玻璃棒。
(5)a.滴定管用蒸馏水洗涤后必须用标准液润洗,因此a正确;b.锥形瓶不需要用待测液润洗,b正确;c.因为碘水为黄色,三价铁离子也是黄色溶液,滴定过程中需加指示剂,c不正确,答案选c。(6)由于所取溶液(含Fe3+)的体积与消耗KI溶液的体积相等,结合方程式2Fe3++2I-=I2+2Fe2+可知,c(Fe3+)=c(KI)=0.5mol•L-1,所以铁元素的物质的量=0.5mol/L×0.25L=0.125mol,所以氧化物中铁与氧的个数之比=0.125mol:0.075mol×2=6:5,因此化学式为Fe5O6。
考点:考查SO2的性质、铁矿石中元素含量测定的实验设计与探究以及化学式确定的有关计算


(1)进行微量实验:如图1所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表.
| 棉球 | 棉球上滴加试剂 | 实验现象 | 解释或结论 |
| a | 棉球变白, 微热后又恢复红色 |
解释: 结论:该气体具有漂白性. | |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式: |
| c | 棉球变为白色 | 化学方程式: 结论:该气体具有 |
①用此装置模拟工业合成盐酸,则关于试剂选择正确的是
②若溶液A为饱和食盐水,气体C为氧气,燃烧管内观察到明亮火焰与浓浓黑烟,则固体B为
| 溶液A | 固体B | 气体C | |
| a | 稀硫酸 | Zn | Cl2 |
| b | 浓盐酸 | MnO2 | H2 |
| c | 稀硝酸 | Fe | Cl2 |
| d | 浓盐酸 | KMnO4 | H2 |
硬质玻璃管是化学实验中经常使用的一种仪器,分析下列实验(固定装置略)并回答:
(1)进行微量实验:如图所示,将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a、b、c三个棉球变化如下表。

| 棉球 | 棉球上滴加试剂 | 实验现象 | 解释或结论 |
| a | _______________ | 棉球变白,微热后又恢复红色 | 解释:__________________ 结论:该气体具有漂白性。 |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式: _________________________ |
| c | 淀粉和___________的混合溶液 | 棉球变为白色 | 化学方程式:_________________ 结论:该气体具有_________性。 |
 (2)如图所示,将硬质玻璃管改装为燃烧管。挤压软塑瓶壁,向装有固体B的锥形瓶中加入溶液A,同时往燃烧管中通入气体C并点燃,可看到明显的燃烧现象(金属网用以防止气体混合爆炸)。
(2)如图所示,将硬质玻璃管改装为燃烧管。挤压软塑瓶壁,向装有固体B的锥形瓶中加入溶液A,同时往燃烧管中通入气体C并点燃,可看到明显的燃烧现象(金属网用以防止气体混合爆炸)。
① 用此装置模拟工业合成盐酸,则关于试剂选择正确的是________(填序号),管口可观察到_______色火焰。
| 溶液A | 固体B | 气体C | |
| a. | 稀硫酸 | Zn | Cl2 |
| b. | 浓盐酸 | MnO2 | H2 |
| c. | 稀硝酸 | Fe | Cl2 |
| d. | 浓盐酸 | KMnO4 | H2 |
②若溶液A为饱和食盐水,气体C为氧气,燃烧管内观察到明亮火焰与浓烈的黑烟,则固体B为_________(填化学式)。此火焰温度极高,常用于切割焊接金属。
(8分)硬质玻璃管是化学实验中经常使用的一种仪器,分析下列实验(固定装置略)并回答:进行微量实验:如图所示,
将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a.b.c三个棉球变化如下表.
请完成下列表格:
| 棉球 | 棉球上滴加试剂 | 实验现象 | 解释或结论 |
| a | _______________ | 棉球变白,微热后又恢复红色 | 解释:__________________ 结论:该气体具有漂白性. |
| b | 含酚酞的NaOH溶液 | 棉球变为白色 | 离子方程式: _________________________ |
| c | 淀粉和 I2 的混合溶液 | 棉球变为白色 | 结论:该气体具有________. |
(8分)硬质玻璃管是化学实验中经常使用的一种仪器,分析下列实验(固定装置略)并回答:进行微量实验:如图所示,

将浓硫酸滴入装有Na2SO3固体的培养皿一段时间后,a.b.c三个棉球变化如下表.
请完成下列表格:
|
棉球 |
棉球上滴加试剂 |
实验现象 |
解释或结论 |
|
a |
_______________ |
棉球变白,微热后又恢复红色 |
解释:__________________ 结论:该气体具有漂白性. |
|
b |
含酚酞的NaOH溶液 |
棉球变为白色 |
离子方程式: _________________________ |
|
c |
淀粉和 I2 的混合溶液 |
棉球变为白色 |
结论:该气体具有________. |


 (2)如图所示,将硬质玻璃管改装为燃烧管.挤压软塑瓶壁,向装有固体B的锥形瓶中加入溶液A,同时往燃烧管中通入气体C并点燃,可看到明显的燃烧现象(金属网用以防止气体混合爆炸).
(2)如图所示,将硬质玻璃管改装为燃烧管.挤压软塑瓶壁,向装有固体B的锥形瓶中加入溶液A,同时往燃烧管中通入气体C并点燃,可看到明显的燃烧现象(金属网用以防止气体混合爆炸).