题目内容
印刷电路板是由塑料和铜箔复合而成,刻制印刷电路时要用FeCl3溶液作为“腐蚀液”溶解铜.(1)写出该反应的化学方程式:
(2)请在上式中标出电子转移的方向和数目
(3)写出FeCl3与足量的Zn反应的化学方程式:
(4)腐蚀液用久会失效,但可以回收利用:
①、若要得到单质铜,下列试剂能实现的是
A、氯气 B、铝 C、硝酸 D、稀硫酸 E、铁
②、若要将Fe2+转化为Fe3+,下列试剂能实现的是
A、氯气 B、铝 C、硝酸 D、稀硫酸 E、铁.
分析:(1)氯化铁溶液与铜反应生成氯化亚铁和氯化铜;
(2)在氧化还原反应中氧化剂得到电子,还原剂失电子,氧化剂和还原剂之间得失电子数目相等,据此利用双线桥法分析该氧化还原反应;
(3)Zn的金属性大于Fe,因此FeCl3与足量的Zn反应生成Fe和氯化锌;
(4)①Cu2+→Cu,化合价降低,需要加还原性大于铜的还原剂,可利用金属单质之间的置换反应;
②将Fe2+转化为Fe3+,需要加入氧化性大于Fe3+的氧化剂.
(2)在氧化还原反应中氧化剂得到电子,还原剂失电子,氧化剂和还原剂之间得失电子数目相等,据此利用双线桥法分析该氧化还原反应;
(3)Zn的金属性大于Fe,因此FeCl3与足量的Zn反应生成Fe和氯化锌;
(4)①Cu2+→Cu,化合价降低,需要加还原性大于铜的还原剂,可利用金属单质之间的置换反应;
②将Fe2+转化为Fe3+,需要加入氧化性大于Fe3+的氧化剂.
解答:解:(1)氯化铁溶液与铜反应生成氯化亚铁和氯化铜,化学方程式为:Cu+2FeCl3═CuCl2+2FeCl2,
故答案为:Cu+2FeCl3═CuCl2+2FeCl2;
(2)在氧化还原反应中氧化剂得到电子,还原剂失电子,氧化剂和还原剂之间得失电子数目相等,用双线桥法可表示为: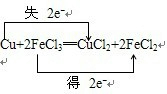 ,
,
故答案为: ;
;
(3)由于Zn的金属性大于Fe,所以FeCl3与足量的Zn反应生成Fe和氯化锌,化学方程式为:2FeCl3+3Zn=2Fe+3ZnCl2,
故答案为:2FeCl3+3Zn=2Fe+3ZnCl2;
(4)①Cu2+→Cu,化合价降低,需要加还原性大于铜的还原剂,故选铁、铝,氯气、硝酸具有强氧化性故AC不选,稀硫酸与Cu2+不反应,故D不选,
故答案为:BE;
②将Fe2+转化为Fe3+,需要加入氧化性大于Fe3+的氧化剂,氯气和硝酸的氧化性均大于Fe3+,故选A、C,铝、铁均具有较强的还原性,故B、E不选,稀硫酸与
Fe3+不反应,故D不选,
故答案为:AC.
故答案为:Cu+2FeCl3═CuCl2+2FeCl2;
(2)在氧化还原反应中氧化剂得到电子,还原剂失电子,氧化剂和还原剂之间得失电子数目相等,用双线桥法可表示为:
 ,
,故答案为:
 ;
;(3)由于Zn的金属性大于Fe,所以FeCl3与足量的Zn反应生成Fe和氯化锌,化学方程式为:2FeCl3+3Zn=2Fe+3ZnCl2,
故答案为:2FeCl3+3Zn=2Fe+3ZnCl2;
(4)①Cu2+→Cu,化合价降低,需要加还原性大于铜的还原剂,故选铁、铝,氯气、硝酸具有强氧化性故AC不选,稀硫酸与Cu2+不反应,故D不选,
故答案为:BE;
②将Fe2+转化为Fe3+,需要加入氧化性大于Fe3+的氧化剂,氯气和硝酸的氧化性均大于Fe3+,故选A、C,铝、铁均具有较强的还原性,故B、E不选,稀硫酸与
Fe3+不反应,故D不选,
故答案为:AC.
点评:本题以铁离子为依托重点考察氧化还原反应原理和金属的置换反应,题目难度中等,侧重于氧化还原反应理论的应用,写出FeCl3与足量的Zn反应为易错点,容易忽略锌的金属性大于铁.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目