题目内容
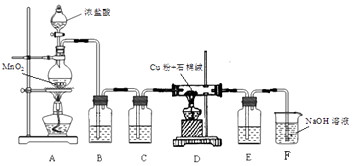
【题目】利用图1和图2中的信息,按图3装置(连接的A、B瓶中已充有NO2气体)进行实验. 
下列说法正确的是( )
A.H2O2中只含有极性共价键,不含离子键
B.2NO2N2O4的平衡常数K随温度升高而减小
C.向H2O2中加入Fe2(SO4)3后,B中颜色变浅
D.H2O2分解反应中Fe2(SO4)3作催化剂,可以使反应的△H减小
【答案】B
【解析】解:A、过氧化氢中含有氧氧非极性键,不是只含极性键,故A错误; B、2mol二氧化氮的能量高于1mol四氧化二氮的能量,故二氧化氮转化为四氧化二氮的反应为放热反应,所以温度越高K值越小,故B正确;
C、B瓶中H2O2在Fe(NO3)3催化剂的作用下分解快,相同时间内放热多,因此B瓶所处温度高,2NO2N2O4平衡逆向移动,NO2浓度大,颜色变深,故C错误;
D、催化剂的使用不改变△H的值,所以H2O2分解反应中Fe2(SO4)3作催化剂,但反应的△H不变,故D错误;
故选B.
A、过氧化氢中含有氧氧非极性键;
B、2mol二氧化氮的能量高于1mol四氧化二氮的能量,故二氧化氮转化为四氧化二氮的反应为放热反应;
C、B瓶中H2O2在Fe(NO3)3催化剂的作用下分解快,相同时间内放热多,因此B瓶所处温度高,2NO2N2O4平衡逆向移动,NO2浓度大,颜色变深;
D、催化剂的使用不改变△H的值.

练习册系列答案
相关题目