题目内容
【题目】证明溶液中是否有Fe2+,其操作正确的顺序是( )
①加少许酸化的KMnO4溶液 ②加少许氯水 ③滴加少许KSCN溶液
A. ①②B. ②③C. ③②D. ①②③
【答案】C
【解析】
首先滴加少许KSCN溶液,再加少许氯水把Fe2+氧化成Fe3+,再利用Fe3+与KSCN溶液混合后成红色的特征反应来验证是否有Fe2+;酸化的KMnO4溶液本身有颜色,不易辨别Fe3+的颜色,则正确的操作顺序为③②;
答案选C。

【题目】红帘石矿的主要成分为Fe3O4、Al2O3、MnCO3、MgO少量MnO2等。工业上将红帘石处理后运用阴离子膜电解法的新技术提取金属钰并制得绿色高效的水处理剂(K2FeO4)。工业流程如下:
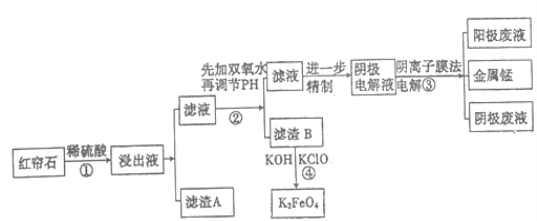
(1)在稀硫酸浸取矿石的过程中,MnO2可将Fe2+氧化为Fe3+,写出该反应的离子方程式:________________________________。
(2)浸出液中的阳离子除H+、Fe2+、Fe3+外还有_______(填离子符号)。
(3)已知:不同金属离子生成生成氢氧化物沉淀所需的pH如下表:
离子 | Fe3+ | A13+ | Fe2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 | 9.6 |
完全沉淀的pH | 3.7 | 4.7 | 9.6 | 9.8 | 11.1 |
步骤②中调节溶液的pH等于6,调节pH的试剂最好选用下列哪种试剂:_______(填选项字母,下同)滤渣B除掉杂质后可进一步制取K2FeO4,除掉滤渣B中杂质最好选用下列哪种试剂:_____。
a.稀盐酸 b.KOH c.氨水 d.MnCO3 e.CaCO3
(4)滤渣B经反应④生成高效水处理剂的离子方程式_________________________。
(5)电解装置如图所示,箭头表示溶液中阴离子移动的方向;阳极电解液是稀硫酸,若阴极上只有锰单质析出,当生成11g锰时,另一个电极上产生的气体在标准状况下的体积为________ L。




