题目内容
I2在KI溶液中存在下列平衡:I2(aq) + I-(aq)  I3-(aq)。某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是
I3-(aq)。某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是
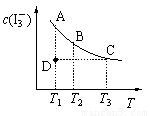
A.反应 I2(aq) + I- (aq)  I3-(aq)的△H>0
I3-(aq)的△H>0
B.状态A与状态B相比,状态A的c(I2)大
C.若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1<K2
D.若反应进行到状态D时,一定有v正>v逆
【答案】
D
【解析】由图像可知,随着温度的升高,生成物的浓度逐渐减小,说明升高温度,平衡向逆反应方向移动,即正反应是放热反应。B点的温度高于A点,即由A→B平衡向逆反应方向移动,反应物的浓度增大。升高温度平衡向逆反应方向移动,所以平衡常数减小。在D点若保持温度不变达到平衡,则需要D→A,在这个过程中生成物的浓度是增加的,说明反应是向正反应方向移动的,即正反应速率大于逆反应速率,所以答案是D。

练习册系列答案
 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案 应用题作业本系列答案
应用题作业本系列答案
相关题目
(2010?广州二模)I2在KI溶液中存在下列平衡:I2(aq)+I-?I3-(aq).测得不同温度下该反应的平衡常数K如下表:
|
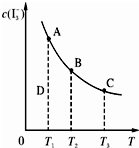 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq).某I2和KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq).某I2和KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )| A、反应I2(aq)+I-(aq)?I3-(aq)的△H<0 | B、若温度为T1、T2,反应的平衡常数分别为K1、K2,则K1<K2 | C、若反应进行到状态D时,一定有v正<v逆 | D、状态A与状态B相比,状态A的c(I2)大 |
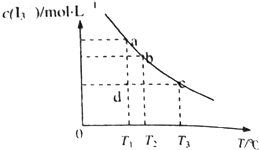 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3(aq),某I2、KI混合溶液中,
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3(aq),某I2、KI混合溶液中,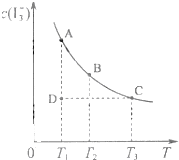 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)═I3-(aq),某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)═I3-(aq),某I2、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )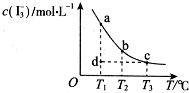 I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq),某I2、KI混合溶液中,c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )
I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)?I3-(aq),某I2、KI混合溶液中,c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是( )