题目内容
(2010?广州二模)I2在KI溶液中存在下列平衡:I2(aq)+I-?I3-(aq).测得不同温度下该反应的平衡常数K如下表:
|
分析:A.由表中数据可知,温度越大平衡常数越小,说明升高温度平衡向逆反应方向移动,据此判断;
B.升高温度平衡向逆反应方向移动;
C.平衡常数指生成物浓度系数次幂的乘积与每反应物浓度系数次幂的乘积的比值;
D.平衡常数只受温度影响,与物质的浓度无关.
B.升高温度平衡向逆反应方向移动;
C.平衡常数指生成物浓度系数次幂的乘积与每反应物浓度系数次幂的乘积的比值;
D.平衡常数只受温度影响,与物质的浓度无关.
解答:解:A.由表中数据可知,温度越大平衡常数越小,说明升高温度平衡向逆反应方向移动,故正反应方向为放热反应,即△H<0,故A错误;
B.升高温度平衡向逆反应方向移动,溶液中c(I3-)减小,故B正确;
C.I2(aq)+I-?I3-(aq)平衡常数k=
,故C错误;
D.加入KI固体,平衡向右移动,但平衡常数只受温度影响,与物质的浓度无关,加入少量KI固体,平衡常数K不变,故D错误;
故选B.
B.升高温度平衡向逆反应方向移动,溶液中c(I3-)减小,故B正确;
C.I2(aq)+I-?I3-(aq)平衡常数k=
| c(I3-) |
| c(I2)?c(I-) |
D.加入KI固体,平衡向右移动,但平衡常数只受温度影响,与物质的浓度无关,加入少量KI固体,平衡常数K不变,故D错误;
故选B.
点评:本题考查温度对化学平衡的影响、化学平衡常数及影响元素,难度不大,注意对基础知识的理解掌握.

练习册系列答案
相关题目
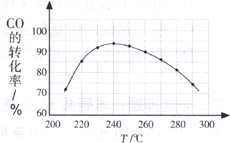 (2010?广州一模)二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用.
(2010?广州一模)二甲醚(CH3OCH3)在未来可能替代柴油和液化气作为洁净液体燃料使用.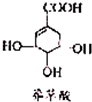 (2010?广州二模)莽草酸可用于合成甲型流感药物--达菲.下列关于莽草酸的叙述正确的是( )
(2010?广州二模)莽草酸可用于合成甲型流感药物--达菲.下列关于莽草酸的叙述正确的是( )