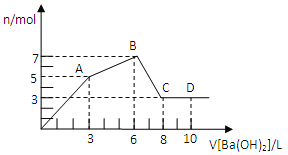
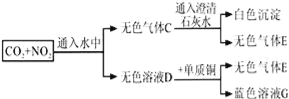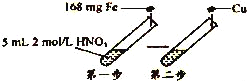题目内容
【题目】下列根据实验操作和现象所得出的结论正确的是

【答案】D
【解析】
试题分析:A.蛋白质中加入NaCl发生盐析,加入CuSO4发生变性,A项错误;B.若原X中含有SO32-,加入稀HNO3,会把SO32-氧化成SO42-,也会出现白色沉淀,B项错误;C.该反应的方程式为:CO2+H2O+Na2SiO3= H2SiO3↓+ Na2CO3,白色沉淀是硅酸,该反应发生的原理为强酸制弱酸,即酸性:H2CO3 >H2SiO3 ,C项错误;D.向BaCl2溶液中通入适量的SO2和Cl2,发生反应为Cl2+SO2+2H2O = 2HCl+H2SO4,H2SO4+BaCl2 =BaSO4 ↓+2HCl,出现白色沉淀,D项正确;答案选D。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
【题目】分析下表中各项的排布规律,按此规律排布第23项应为
1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
C2H6 | C2H4 | C2H4O2 | C3H8 | C3H6 | C3H6O2 | C4H10 | C4H8 | C4H8O2 | C5H12 |
A.C8H18 B.C9H118O2 C.C9H18 D.C8H16O2