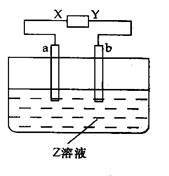
题目内容
用铂电极电解CuSO4和KNO3的混合溶液500 mL,经过一段时间后,两极均得到标准状况下11.2 L的气体,则原混合溶液中CuSO4的物质的量浓度为( )
| A.0.5 mol?L-1 | B.0.8 mol?L-1 |
| C.1.0 mol?L-1 | D.1.5 mol?L-1 |
C
阳极发生电极反应:4OH--4e-=2H2O+O2↑,失去电子的物质的量=n(O2)×4="(11.2/22.4)×4" mol="2" mol;阴极发生电极反应:首先发生的是Cu2++2e-=Cu,其次是2H++2e-=H2↑,阴极得到电子的物质的量=n(Cu2+)×2+n(H2)×2=n(Cu2+)×2+(11.2/22.4)×2mol,两电极物质得失电子数相等,即2 mol=n(Cu2+)×2+(11.2/22.4)×2 mol。解得n(Cu2+)="0.5" mol,n(CuSO4)=n(Cu2+)="0.5" mol,其物质的量浓度="0.5" mol/(500×10-3L)="1.0" mol·L-1,答案为C。

练习册系列答案
相关题目
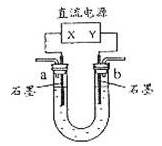
 ),食盐水装在U形管中,结果很快在某一电极附近出现食盐水浑浊的现象。造成浑浊的难溶物主要是…( )
),食盐水装在U形管中,结果很快在某一电极附近出现食盐水浑浊的现象。造成浑浊的难溶物主要是…( ) 为直流电源,
为直流电源, 为浸透饱和氯化钠溶液和酚酞试液的滤纸,
为浸透饱和氯化钠溶液和酚酞试液的滤纸, 为电镀槽。接通电路后,发现c点显红色,请填空:
为电镀槽。接通电路后,发现c点显红色,请填空: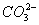 的浓度减小
的浓度减小 Zn
Zn