题目内容
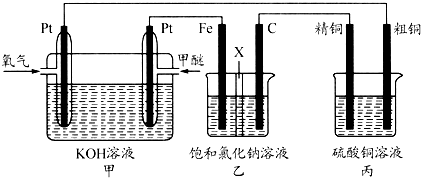
如图所示,某同学设计一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.

根据要求回答相关问题:
(1)通入氧气的电极为
(2)铁电极为
(3)反应一段时间后,乙装置中生成氢氧化钠主要在
(4)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将
(5)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为

根据要求回答相关问题:
(1)通入氧气的电极为
正极
正极
(填“正极”或“负极”),写出负极的电极反应式CH3OCH3-12e-+16OH-═2CO32-+11H2O
CH3OCH3-12e-+16OH-═2CO32-+11H2O
.(2)铁电极为
阴极
阴极
(填“阳极”或“阴极”),石墨电极(C)的电极反应式为2Cl--2e-═Cl2↑
2Cl--2e-═Cl2↑
.(3)反应一段时间后,乙装置中生成氢氧化钠主要在
铁极
铁极
(填“铁极”或“石墨极”)区(4)如果粗铜中含有锌、银等杂质,丙装置中反应一段时间,硫酸铜溶液浓度将
减小
减小
(填“增大”“减小”或“不变”).(5)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为
0.2×6.02×1023
0.2×6.02×1023
;丙装置中阴极析出铜的质量为12.8g
12.8g
.分析:(1)燃料电池是将化学能转变为电能的装置,属于原电池,投放燃料的电极是负极,负极上燃料失电子发生氧化反应,投放氧化剂的电极是正极,正极上氧化剂得电子发生还原反应;
(2)电解饱和氯化钠溶液时,连接原电池负极的电极是阴极,连接原电池正极的电极是阳极,阳极上氯离子放电,阴极上氢离子放电,注意如果活泼电极作阳极,则阳极上电极材料放电而不是溶液中阴离子放电;
(3)电解饱和氯化钠溶液时,阴极上氢离子放电,导致氢氧根离子浓度大于氢离子浓度而使溶液呈碱性;
(4)粗铜精炼时,粗铜作阳极,阳极上金属失电子,阴极上铜离子得电子,根据阴阳极上金属的变化确定溶液中铜离子是否变化;
(5)串联电池中转移电子数相等,根据转移电子数相等计算乙装置中铁电极上生成的气体的分子数及丙装置中阴极析出铜的质量.
(2)电解饱和氯化钠溶液时,连接原电池负极的电极是阴极,连接原电池正极的电极是阳极,阳极上氯离子放电,阴极上氢离子放电,注意如果活泼电极作阳极,则阳极上电极材料放电而不是溶液中阴离子放电;
(3)电解饱和氯化钠溶液时,阴极上氢离子放电,导致氢氧根离子浓度大于氢离子浓度而使溶液呈碱性;
(4)粗铜精炼时,粗铜作阳极,阳极上金属失电子,阴极上铜离子得电子,根据阴阳极上金属的变化确定溶液中铜离子是否变化;
(5)串联电池中转移电子数相等,根据转移电子数相等计算乙装置中铁电极上生成的气体的分子数及丙装置中阴极析出铜的质量.
解答:解:(1)燃料电池是将化学能转变为电能的装置,属于原电池,投放燃料的电极是负极,投放氧化剂的电极是正极,所以通入氧气的电极是正极,负极上甲醚失电子和氢氧根离子反应生成碳酸根离子和水,
电极反应式为:CH3OCH3-12e-+16OH-═2CO32-+11H2O;
故答案为:正极,CH3OCH3-12e-+16OH-═2CO32-+11H2O;
(2)乙池有外接电源属于电解池,铁电极连接原电池的负极,所以是阴极,则石墨电极是阳极,阳极上氯离子放电生成氯气,电极反应式为:2Cl--2e-═Cl2↑;
故答案为:2Cl--2e-═Cl2↑;
(3)乙池中阴极是铁,阳极是碳,阳极上氯离子放电生成氯气,阴极上氢离子放电,导致阴极附近氢氧根离子浓度大于氢离子浓度溶液呈碱性,所以乙装置中生成氢氧化钠主要在铁极区;
故答案为:铁极;
(4)如果粗铜中含有锌、银等杂质,阳极上不仅铜还有锌、银失电子进入溶液,阴极上析出铜,根据转移电子数相等知,阳极上溶解的铜小于阴极上析出的铜,所以丙装置中反应一段时间,硫酸铜溶液浓度将减小;
故答案为:减小;
(5)根据串联电池中转移电子数相等得氧气、氢气和铜的关系式为:O2----2H2----2Cu,设生成氢气的分子数是x,生成铜的质量是y.
O2-------2H2-------2Cu
22.4L 26.02×1023 128g
2.24L x y
x=0.2×6.02×1023
y=12.8g
故答案为:0.2×6.02×1023,12.8 g.
电极反应式为:CH3OCH3-12e-+16OH-═2CO32-+11H2O;
故答案为:正极,CH3OCH3-12e-+16OH-═2CO32-+11H2O;
(2)乙池有外接电源属于电解池,铁电极连接原电池的负极,所以是阴极,则石墨电极是阳极,阳极上氯离子放电生成氯气,电极反应式为:2Cl--2e-═Cl2↑;
故答案为:2Cl--2e-═Cl2↑;
(3)乙池中阴极是铁,阳极是碳,阳极上氯离子放电生成氯气,阴极上氢离子放电,导致阴极附近氢氧根离子浓度大于氢离子浓度溶液呈碱性,所以乙装置中生成氢氧化钠主要在铁极区;
故答案为:铁极;
(4)如果粗铜中含有锌、银等杂质,阳极上不仅铜还有锌、银失电子进入溶液,阴极上析出铜,根据转移电子数相等知,阳极上溶解的铜小于阴极上析出的铜,所以丙装置中反应一段时间,硫酸铜溶液浓度将减小;
故答案为:减小;
(5)根据串联电池中转移电子数相等得氧气、氢气和铜的关系式为:O2----2H2----2Cu,设生成氢气的分子数是x,生成铜的质量是y.
O2-------2H2-------2Cu
22.4L 26.02×1023 128g
2.24L x y
x=0.2×6.02×1023
y=12.8g
故答案为:0.2×6.02×1023,12.8 g.
点评:本题以原电池和电解池原理为载体考查了电极反应式的书写、物质的量的有关计算等知识点,注意燃料电池中电极反应式的书写要结合电解质溶液的酸碱性,燃料相同,如果电解质溶液不同,电极反应式则不同,为易错点.

练习册系列答案
相关题目


 任意1种
任意1种