题目内容
如图所示,某同学设计一个甲醚(CH3OCH3)燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.
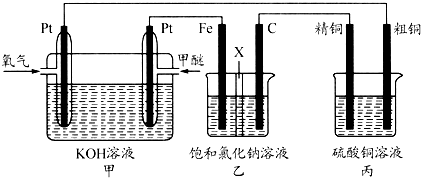
根据要求回答相关问题:
(1)通入氧气的电极为 (填“正极”或“负极”),写出负极的电极反应式 .
(2)铁电极为 (填“阳极”或“阴极”),石墨电极(C)的电极反应式为 .
(3)反应一段时间后,乙装置中生成氢氧化钠主要在 (填“铁极”或“石墨极”)区,简述理由是 .
(4)如果粗铜中含有锌、银等杂质,丙装置中阳极上电极反应式为 ,反应一段时间,硫酸铜溶液浓度将 (填“增大”“减小”或“不变”).
(5)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为 ;丙装置中阴极析出铜的质量为 .

根据要求回答相关问题:
(1)通入氧气的电极为
(2)铁电极为
(3)反应一段时间后,乙装置中生成氢氧化钠主要在
(4)如果粗铜中含有锌、银等杂质,丙装置中阳极上电极反应式为
(5)若在标准状况下,有2.24L氧气参加反应,则乙装置中铁电极上生成的气体的分子数为
分析:(1)原电池中,正极发生还原反应,负极发生氧化反应,投入氧气的一极为正极,负极甲醚失电子被氧化生成碳酸根离子;
(2)铁电极连接原电池的负极,为电解池的阴极,石墨为阳极,氯离子放电被氧化生成氯气;
(3)乙装置为电解氯化钠装置,氢氧化钠在阴极生成;
(4)活泼性Zn>Cu>Ag,阳极上锌、铜被氧化;
(5)据串联电池中转移电子数相等得氧气、氢气和铜的关系式为:O2----2H2----2Cu计算.
(2)铁电极连接原电池的负极,为电解池的阴极,石墨为阳极,氯离子放电被氧化生成氯气;
(3)乙装置为电解氯化钠装置,氢氧化钠在阴极生成;
(4)活泼性Zn>Cu>Ag,阳极上锌、铜被氧化;
(5)据串联电池中转移电子数相等得氧气、氢气和铜的关系式为:O2----2H2----2Cu计算.
解答:解:(1)燃料电池是将化学能转变为电能的装置,属于原电池,投放燃料的电极是负极,投放氧化剂的电极是正极,所以通入氧气的电极是正极,负极上甲醚失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH3OCH3-12e-+16OH-═2CO32-+11H2O,
故答案为:正极;CH3OCH3-12e-+16OH-═2CO32-+11H2O;
(2)乙池有外接电源属于电解池,铁电极连接原电池的负极,所以是阴极,则石墨电极是阳极,阳极上氯离子放电生成氯气,电极反应式为:2Cl--2e-═Cl2↑,
故答案为:阴极;2Cl--2e-═Cl2↑;
(3)乙池中阴极是铁,阳极是碳,阳极上氯离子放电生成氯气,阴极上氢离子放电,导致阴极附近氢氧根离子浓度大于氢离子浓度溶液呈碱性,所以乙装置中生成氢氧化钠主要在铁极区,
故答案为:铁极;石墨为阳极,氯离子发生氧化反应,铁为阴极,H+反应,生成OH-,由于阳离子交换膜只允许钠离子向阴极区移动,故氢氧化钠主要在阴极区生成;
(4)如果粗铜中含有锌、银等杂质,阳极上不仅铜还有锌、银失电子进入溶液,阴极上析出铜离子,阳极电极方程式分别为Zn-2e-=Zn2+、Cu-2e-=Cu2+,根据转移电子数相等知,阳极上溶解的铜小于阴极上析出的铜,所以丙装置中反应一段时间,硫酸铜溶液浓度将减小,
故答案为:Zn-2e-=Zn2+、Cu-2e-=Cu2+;减小;
(5)根据串联电池中转移电子数相等得氧气、氢气和铜的关系式为:O2----2H2----2Cu,设生成氢气的分子数是x,生成铜的质量是y.
O2-------2H2-------2Cu
22.4L 2×6.02×1023 128g
2.24L x y
x=0.2×6.02×1023;
y=12.8g,
故答案为:0.2×6.02×1023;12.8 g.
故答案为:正极;CH3OCH3-12e-+16OH-═2CO32-+11H2O;
(2)乙池有外接电源属于电解池,铁电极连接原电池的负极,所以是阴极,则石墨电极是阳极,阳极上氯离子放电生成氯气,电极反应式为:2Cl--2e-═Cl2↑,
故答案为:阴极;2Cl--2e-═Cl2↑;
(3)乙池中阴极是铁,阳极是碳,阳极上氯离子放电生成氯气,阴极上氢离子放电,导致阴极附近氢氧根离子浓度大于氢离子浓度溶液呈碱性,所以乙装置中生成氢氧化钠主要在铁极区,
故答案为:铁极;石墨为阳极,氯离子发生氧化反应,铁为阴极,H+反应,生成OH-,由于阳离子交换膜只允许钠离子向阴极区移动,故氢氧化钠主要在阴极区生成;
(4)如果粗铜中含有锌、银等杂质,阳极上不仅铜还有锌、银失电子进入溶液,阴极上析出铜离子,阳极电极方程式分别为Zn-2e-=Zn2+、Cu-2e-=Cu2+,根据转移电子数相等知,阳极上溶解的铜小于阴极上析出的铜,所以丙装置中反应一段时间,硫酸铜溶液浓度将减小,
故答案为:Zn-2e-=Zn2+、Cu-2e-=Cu2+;减小;
(5)根据串联电池中转移电子数相等得氧气、氢气和铜的关系式为:O2----2H2----2Cu,设生成氢气的分子数是x,生成铜的质量是y.
O2-------2H2-------2Cu
22.4L 2×6.02×1023 128g
2.24L x y
x=0.2×6.02×1023;
y=12.8g,
故答案为:0.2×6.02×1023;12.8 g.
点评:本题考查原电池和电解池知识,为高考常见题型,侧重于学生的分析能力和计算能力的考查,注意把握电极方程式的书写,为解答该题的关键,结合串联电路的特点解答该题,难度不大.

练习册系列答案
相关题目


 任意1种
任意1种
