题目内容
2.取不同质量的镁铝合金分别与25mL同浓度的稀硝酸反应,测量合金的质量与产生的NO气体的体积(标准状况),列表如下:| 实验编号 | 合金质量(mg) | NO体积(mL) |
| 1 | 144 | 112 |
| 2 | 288 | 224 |
| 3 | 864 | 560 |
| A. | 硝酸的浓度为4.0mol•L-1 | B. | 硝酸的浓度为1.0mol•L-1 | ||
| C. | 至少需要NaOH溶液的体积为75mL | D. | 至少需要NaOH溶液的体积为85mL |
分析 分析1、2组数据可知,金属的质量之比等于对应NO的体积之比,说明1、2组金属完全反应,第3组金属若完全反应,可得NO体积为224mL×$\frac{864g}{288g}$=672mL>560mL,故第3组金属有剩余,硝酸完全反应;第3个实验后向反应容器内加入足量的1.0mol/L NaOH(aq)充分反应,使固体质量不再发生变化,使氢氧化铝恰好转化为NaAlO2,需要氢氧化钠溶液的体积最小,此时溶液中溶质为NaNO3、NaAlO2;根据n=$\frac{V}{{V}_{m}}$计算第3组生成的NO的物质的量,由反应3Zn+8HNO3=3Zn(NO3)2+2NO↑+4H2O、Al+4HNO3=Al(NO3)3+NO↑+2H2O可知,起氧化剂作用的硝酸为总的硝酸的$\frac{1}{4}$,据此计算25mL硝酸溶液中n(HNO3)、起酸性作用的硝酸的物质的量,根据c=$\frac{n}{V}$计算原硝酸溶液的浓度;令144mg合金中Mg、Al的物质的量分别为xmol、ymol,根据二者质量与转移电子数目列方程计算x、y的值,进而计算864mg合金中Al的物质的量,根据钠离子守恒可知n(NaOH)=n(NaNO3)+n(NaAlO2),再根据V=$\frac{n}{c}$计算需要氢氧化钠溶液的最小体积.
解答 解:分析1、2组数据可知,金属的质量之比等于对应NO的体积之比,说明1、2组金属完全反应,第3组金属若完全反应,可得NO体积为224mL×$\frac{864g}{288g}$=672mL>560mL,故第3组金属有剩余,硝酸完全反应;第3个实验后向反应容器内加入足量的1.0mol/L NaOH(aq)充分反应,使固体质量不再发生变化,使氢氧化铝恰好转化为NaAlO2,需要氢氧化钠溶液的体积最小,此时溶液中溶质为NaNO3、NaAlO2;
第3组生成的NO的物质的量为$\frac{0.56L}{22.4L/mol}$=0.025mol,由反应3Zn+8HNO3=3Zn(NO3)2+2NO↑+4H2O、Al+4HNO3=Al(NO3)3+NO↑+2H2O可知,起氧化剂作用的硝酸为总的硝酸的$\frac{1}{4}$,故25mL硝酸溶液中n(HNO3)=0.025mol÷$\frac{1}{4}$
=0.1mol,原硝酸溶液的浓度为$\frac{0.1mol}{0.025L}$=4mol/L.
起酸性作用的硝酸的物质的量为0.1mol-0.025mol=0.075mol,
令144mg合金中Mg、Al的物质的量分别为xmol、ymol,由二者质量与转移电子数目守恒有:
$\left\{\begin{array}{l}{2x+3y=\frac{0.112}{22.4}×3}\\{24x+27y=0.144}\end{array}\right.$
解得x=0.0015,y=0.004,
故864mg合金中Al的物质的量0.004mol×$\frac{864mg}{144mg}$=0.024mol,根据钠离子守恒可知n(NaOH)=n(NaNO3)+n(NaAlO2)=0.075mol+0.024mol=0.099mol,故需要氢氧化钠溶液的最小体积为$\frac{0.099mol}{1mol/L}$=0.099L=99mL,
故选A.
点评 本题考查混合物的有关计算,过程复杂、计算量较大,题目难度较大,注意利用守恒思想进行的解答.

 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案| A. | 浓硫酸起吸水和催化作用 | B. | 药品加入顺序为:浓硫酸→乙醇 | ||
| C. | 反应原理是取代反应 | D. | 温度计水银球应该插入溶液中 |
| A. | 2KMnO4+11H2S+5H2SO4→K2SO4+2MnSO4+13S↓+16H2O | |
| B. | 2KMnO4+8H2S+4H2SO4→K2SO4+2MnSO4+9S↓+12H2O | |
| C. | 2KMnO4+5H2S+3H2SO4→K2SO4+2MnSO4+S↓+4H2O | |
| D. | 2KMnO4+5H2S+3H2SO4→K2SO4+2MnSO4+5S↓+8H2O |
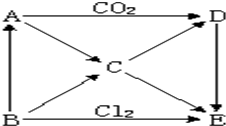 下图表示A~E五种物质间的相互转化关系,其中A为淡黄色固体,B为金属单质.试推出各物质的化学式,并写出有关反应的化学方程式.
下图表示A~E五种物质间的相互转化关系,其中A为淡黄色固体,B为金属单质.试推出各物质的化学式,并写出有关反应的化学方程式.
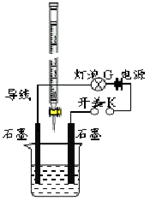 某温度下,水的离子积Kw=l×10-13.有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.
某温度下,水的离子积Kw=l×10-13.有酸溶液A,pH=a;碱溶液B,pH=b.为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置.