题目内容
4.下列说法正确的是( )| A. | 相同条件下,若1mol氢原子所具有的能量为E1,1mol氢分子具有的能量为E2,则2E1>E2 | |
| B. | 已知4A(g)+5B(g)?4C(g)+6D(g)△H<0,向平衡容器里继续加入A和B,△H会减小 | |
| C. | 浓硫酸用水稀释过程是放热的,所以稀释浓硫酸是一个放热反应. | |
| D. | 用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以加快产生氢气的速率 |
分析 A、分子断键形成原子时吸收能量,根据吸热反应的能量变化特点计算;
B、反应的焓变和反应物生成物的能量有关,和物质的浓度大小没关系;
C、浓硫酸的稀释是一个物理变化过程;
D、金属铁和浓硫酸反应的产物不是氢气而是二氧化硫.
解答 解:A、1mol氢分子断键变成2molH原子时吸收能量,所以2molH原子所含能量比1mol氢分子高,2E1>E2,故A正确;
B、向平衡容器里继续加入A和B,△H不会发生变化,故B错误;
C、浓硫酸用水稀释过程是放热的,稀释浓硫酸是一个放热过程,不属于化学反应过程,故C错误;
D、用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸不会加快产生氢气的速率,因为金属铁和浓硫酸反应的产物不是氢气而是二氧化硫,故D错误.
故选A.
点评 本题涉及化学反应的热效应、影响化学反应速率的因素以及焓变的影响因素等知识,属于综合知识的考查,难度中等.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
14.NA为阿伏伽德罗常数值下列说法正确的是( )
| A. | 30g丙醇中存在的共价键总数为5NA | |
| B. | 密闭容器中2mol NO与1mol O2充分反应,转移的电子数为2NA | |
| C. | 常温常压下,22.4L氯气与足量镁粉充分反应,转移的电子总数为2NA | |
| D. | 2.8g乙烯和环丁烷(C4H8)的混合气体中含有的原子总数为0.6NA |
19.下列各组离子在强酸性的溶液中能大量共存,且溶液无色透明的是( )
| A. | Cu2+、Cl-、K+、SO42- | B. | CO32-、Na+、K+、SO42- | ||
| C. | Mg2+、Cl-、K+、NO3- | D. | Ag+、NO3-、K+、Cl- |
16.图为用惰性电极电解NaCl溶液制备盐酸和氢氧化钠的装置图,下列说法正确的是( )


| A. | a和c为阳离子交换膜,b和d为阴离子交换膜 | |
| B. | ③与④两种气体体积比为1:1 | |
| C. | ①处生成的物质为氢氧化钠 | |
| D. | 当转移2mol e-时,A处减少离子数为2NA |
13.CuI是一种不溶于水的白色固体,它可以由反应:2Cu2++4I-=2CuI↓+I2而得到.现以石墨为阴极,以Cu为阳极电解KI溶液,通电前向电解液中加入少量酚酞和淀粉溶液.电解开始不久,阴极区溶液呈红色,而阳极区溶液呈蓝色,同时有白色沉淀生成.下列说法中正确的是( )
| A. | 对阳极区溶液呈蓝色的正确解释是:2I--2e-=I2,碘遇淀粉变蓝 | |
| B. | 对阳极区溶液呈蓝色的正确解释是:Cu-2e-=Cu2+,Cu2+显蓝色 | |
| C. | 阴极区溶液呈红色的原因是:2H++2e-=H2↑,使阴极附近OH- 浓度增大,溶液显碱性,从而使酚酞变红 | |
| D. | 阴极上的电极反应式为:Cu2++2e-=Cu |
14.下列分子中的所有原子一定在同一平面上的是( )
| A. | 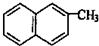 | B. | 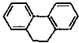 | C. | 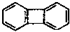 | D. | 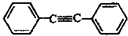 |

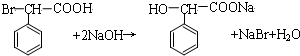 .
. .
.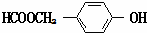 (写结构简式).
(写结构简式). 目前城市空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应:
目前城市空气质量恶化原因之一是机动车尾气和燃煤产生的烟气.NO和CO均为汽车尾气的成分,这两种气体在催化转换器中发生如下反应: