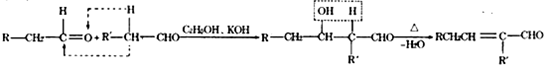题目内容
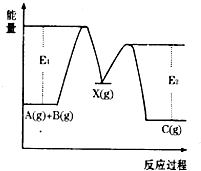 (2013?临沂一模)反应A(g)+B(g)→C(g)△H,分两步进行:①A(g)+B(g)→X(g)△H1 ②X(g)→C(g)△H2,反应过程中能量变化如图所示,E1表示A+B→X的活化能,下列说法正确的是( )
(2013?临沂一模)反应A(g)+B(g)→C(g)△H,分两步进行:①A(g)+B(g)→X(g)△H1 ②X(g)→C(g)△H2,反应过程中能量变化如图所示,E1表示A+B→X的活化能,下列说法正确的是( )分析:A.依据盖斯定律来分析反应热的关系,然后根据反应物的总能量和生成物的总能量的大小判断是吸热还是放热;
B.依据催化剂是先作为反应物参与化学反应,然后再通过化学反应转变成原物质;
C.依据分子从常态转变为容易发生化学反应的活跃状态所需要的能量称为活化能;
D.依据图象能量关系可知,反应的焓变=逆反应的活化能-正反应的活化能.
B.依据催化剂是先作为反应物参与化学反应,然后再通过化学反应转变成原物质;
C.依据分子从常态转变为容易发生化学反应的活跃状态所需要的能量称为活化能;
D.依据图象能量关系可知,反应的焓变=逆反应的活化能-正反应的活化能.
解答:解:A.①A(g)+B(g)→X(g)△H1 ②X(g)→C(g)△H2,①+②得:A(g)+B(g)→C(g)△H=△H1+△H2,所以△Hl=△H-△AH2,由图可知:A(g)+B(g)→X(g)△H1 中反应的总能量小于生成物的总能量,为吸热反应,所以△H1>0,故A正确;
B.若X是反应A(g)+B(g)→C(g)的催化剂,则X是反应①的反应物,是反应②的生成物,故B错误;
C.反应②的活化能E1-E2,故C错误;
D.反应A(g)+B(g)→C(g)的正反应的活化能为E1,逆反应的活化能大于E2,反应的焓变大于E2-E1,故D错误;
故选A.
B.若X是反应A(g)+B(g)→C(g)的催化剂,则X是反应①的反应物,是反应②的生成物,故B错误;
C.反应②的活化能E1-E2,故C错误;
D.反应A(g)+B(g)→C(g)的正反应的活化能为E1,逆反应的活化能大于E2,反应的焓变大于E2-E1,故D错误;
故选A.
点评:本题是盖斯定律的应用、化学反应的能量变化与反应的焓变关系的分析判断,反应活化能的判断计算,读懂图象,焓变和活化能计算方法的理解是解题的关键.

练习册系列答案
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案
相关题目
 (2013?临沂一模)某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的PH变化曲线如图所示,下列判断正确的是( )
(2013?临沂一模)某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的PH变化曲线如图所示,下列判断正确的是( )
 (2013?临沂一模)【化学--物质结构与性质】
(2013?临沂一模)【化学--物质结构与性质】