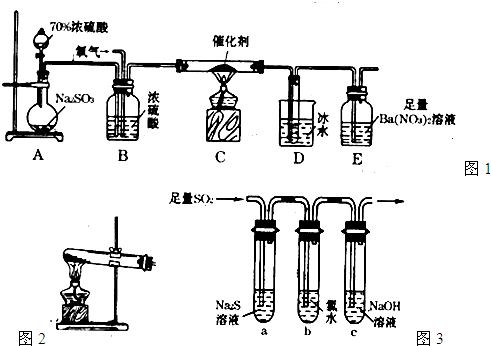
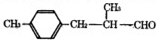
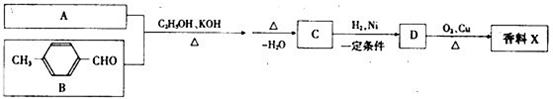
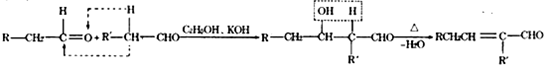题目内容
 (2013?临沂一模)【化学--物质结构与性质】
(2013?临沂一模)【化学--物质结构与性质】碳是形成化合物种类最多的元素.
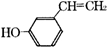
(1)CH2=CH-C≡N是制备晴纶的原料,其分子中σ键和π键的个数之比为
2:1
2:1
(填最简整数比),写出该分子中所有碳原子的杂化方式sp2、sp
sp2、sp
.(2)乙醇(CH3CH2OH)与二甲醚(OH3OCH3)的分子式均为C2H6O,但CH3CH2OH的沸点高于CH3OCH3的沸点,其原因是
乙醇分子之间形成氢键
乙醇分子之间形成氢键
.(3)某元素位于第四周期VIII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,则其基态原子的价层电子排布式为
3d84s2
3d84s2
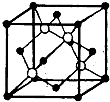
.(4)碳化硅的结构与金刚石类似,其硬度仅次于金刚石,具有较强的耐磨性能.如图所示为碳化硅的晶胞(其中●为碳原子,○为硅原子).每个碳原子周围与其距离最近的硅原子有
4
4
个.设晶胞边长为a cm,密度为b g/cm3,则阿伏加德罗常数可表示为| 160 |
| a3b |
| 160 |
| a3b |
分析:(1)共价单键为σ键,双键中有1个σ键和1个π键,三键中有1个σ键和2个π键,分子中C=C中的C不存在孤对电子,σ键数为3,C≡N中C不存在孤对电子,σ键数为2;
(2)CH3CH2OH含氢键,使其沸点升高;
(3)元素位于第四周期VIII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,C原子的电子排布为1s22s22p2,未成对电子数为2,则该元素为Ni;
(4)由碳化硅的晶胞可知,每个碳原子周围与其距离最近的硅原子有4个,晶胞中Si为8×
+6×
=4,则4个SiC其质量为a3b,NA个SiC其质量为40g,以此解答.
(2)CH3CH2OH含氢键,使其沸点升高;
(3)元素位于第四周期VIII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,C原子的电子排布为1s22s22p2,未成对电子数为2,则该元素为Ni;
(4)由碳化硅的晶胞可知,每个碳原子周围与其距离最近的硅原子有4个,晶胞中Si为8×
| 1 |
| 8 |
| 1 |
| 2 |
解答:解:(1)共价单键为σ键,双键中有1个σ键和1个π键,三键中有1个σ键和2个π键,CH2=CH-C≡N含6个σ键和3个π键,所以σ键和π键的个数之比为6:3=2:1,分子中C=C中的C不存在孤对电子,σ键数为3,为sp2杂化,而C≡N中C不存在孤对电子,σ键数为2,为sp杂化,
故答案为:2:1;sp2、sp;
(2)CH3CH2OH含氢键,使其沸点升高,CH3CH2OH的沸点高于CH3OCH3的沸点,其原因是乙醇分子之间形成氢键,故答案为:乙醇分子之间形成氢键;
(3)元素位于第四周期VIII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,C原子的电子排布为1s22s22p2,未成对电子数为2,则该元素为Ni,其基态原子的价层电子排布式为3d84s2,故答案为:3d84s2;
(4)由碳化硅的晶胞可知,每个碳原子周围与其距离最近的硅原子有4个,晶胞中Si为8×
+6×
=4,则4个SiC其质量为a3b,NA个SiC其质量为40g,则阿伏加德罗常数可表示为
,故答案为:4;
.
故答案为:2:1;sp2、sp;
(2)CH3CH2OH含氢键,使其沸点升高,CH3CH2OH的沸点高于CH3OCH3的沸点,其原因是乙醇分子之间形成氢键,故答案为:乙醇分子之间形成氢键;
(3)元素位于第四周期VIII族,其基态原子的未成对电子数与基态碳原子的未成对电子数相同,C原子的电子排布为1s22s22p2,未成对电子数为2,则该元素为Ni,其基态原子的价层电子排布式为3d84s2,故答案为:3d84s2;
(4)由碳化硅的晶胞可知,每个碳原子周围与其距离最近的硅原子有4个,晶胞中Si为8×
| 1 |
| 8 |
| 1 |
| 2 |
| 160 |
| a3b |
| 160 |
| a3b |
点评:本题考查知识点较多,为原子结构习题,涉及电子排布、共价键形成、氢键对物质性质的影响、晶体结构及其计算,(3)为解答的难点,题目难度中等.

练习册系列答案
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案
相关题目
 (2013?临沂一模)某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的PH变化曲线如图所示,下列判断正确的是( )
(2013?临沂一模)某温度下,体积和pH都相同的盐酸和氯化铵溶液加水稀释时的PH变化曲线如图所示,下列判断正确的是( )