题目内容
【题目】硼及其化合物在耐高潮合金工业、催化剂制造、高能燃料等方面有广泛应用.
(1)硼原子的价电子排布图为 .
(2)B2H6是一种高能燃料,它与Cl2反应生成的BCl3可用于半导体掺杂工艺及高纯硅制造.由第2周期元素组成的与BCl3互为等电子体的阴离子为 .
(3)氮硼烷化合物(H2N→BH2)和Ti(BH4)3均为广受关注的新型化学氮化物储氢材料.
①B与N的第一电离能:BN(填“>”、“<”或“=”,下同).H2N→BH2中B原子的杂化类型为;
②Ti(BH4)3由TiCl3和LiBH4反应制得.BH4﹣的立体构型是;写出制备反应的化学方程式;
(4)磷化硼(BP)是受到高度关注的耐麿材料,它可用作金属表面的保护层.如图为磷化硼晶胞.
①磷化硼晶体属于晶体(填晶体类型),(填是或否)含有配位键.
②晶体中P原子的配位数为 .
③已知BP的晶胞边长为anm,NA为阿伏加德罗常数的数值,则磷化硼晶体的密度为gcm﹣3(用含a、NA的式子表示).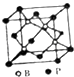
【答案】
(1)![]()
(2)CO32﹣或NO3﹣
(3)<;sp2;正四面体;TiCl3+3LiBH4═Ti(BH4)3+3LiCl
(4)原子;是;4;![]()
【解析】解:(1.)硼是5号元素,价电子数为3,价电子排布图为 ![]() ,所以答案是:
,所以答案是: ![]() ;
;
(2.)根据等电子体原理,原子数相同,价电子数也相同的粒子互为等电子体,所以由第2周期元素组成的与BCl3互为等电子体的阴离子为CO32﹣或NO3﹣ , 所以答案是:CO32﹣或NO3﹣;
(3.)①根据元素周期律,同周期元素从左向右第一电离能逐渐增大,所以B的第一电离能小于N,H2N→BH2中B原子的价层电子对数为 ![]() =3,所以B原子杂化方式为sp2,所以答案是:<;sp2;②BH4﹣中B原子的价层电子对数为
=3,所以B原子杂化方式为sp2,所以答案是:<;sp2;②BH4﹣中B原子的价层电子对数为 ![]() =4,所以杂化方式为sp3杂化,则BH4﹣的立体构型为正四面体,Ti(BH4)3由TiCl3和LiBH4反应制得,反应的化学方程式为TiCl3+3LiBH4═Ti(BH4)3+3LiCl,所以答案是:正四面体;TiCl3+3LiBH4═Ti(BH4)3+3LiCl;
=4,所以杂化方式为sp3杂化,则BH4﹣的立体构型为正四面体,Ti(BH4)3由TiCl3和LiBH4反应制得,反应的化学方程式为TiCl3+3LiBH4═Ti(BH4)3+3LiCl,所以答案是:正四面体;TiCl3+3LiBH4═Ti(BH4)3+3LiCl;
(4.)①在磷化硼晶体中,磷和硼原子之间通过共价键相互作用,结合性质可知其晶体类型为原子晶体,硼最外层有3个电子,但根据晶胞结构可知,每个硼和磷周围都有4个共价键,所以磷原子含有孤电子对,硼原子含有空轨道,它们之间存在配位键,所以答案是:原子;是;
②根据晶的结构图可知,每个磷原子周围有4个硼原子,所以配位数为4,所以答案是:4;
③BP的晶胞边长为anm=a×10﹣7 cm,其体积为(a×10﹣7 cm)3 , 根据晶胞图可知,每个晶胞中含有B原子数为4,P原子数为 ![]() =4,所以磷化硼晶体的密度为
=4,所以磷化硼晶体的密度为  gcm﹣3=
gcm﹣3= ![]() gcm﹣3 , 所以答案是:
gcm﹣3 , 所以答案是: ![]() .
.




