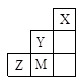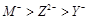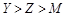题目内容
六种短周期元素(a、b、c、d、e、f)的原子序数依次增大。其中a与e同主族,b与f同主族,e与f同周期;常温下a、e的单质状态不同;d的核电荷数是b的最外层电子数的2倍;单质f是一种重要的半导体材料。由此可推知
| A.a、c两种元素只能组成化学式为ca3的化合物 |
| B.b、c、d分别与a形成的化合物,沸点由高到低依次为:d>c>b |
| C.原子半径由大到小的顺序是 e>f>b>c>a |
| D.元素的非金属性由强到弱的顺序是 d>c>f>b |
C
试题分析:单质f是一种重要的半导体材料,即为硅。b为碳。d的核电荷数是b的最外层电子数的2倍,d是氧;常温下a、e的单质状态不同,说明分别是氢和钠,则c为氟。A.a、c两种元素只能组成化学式为HF,错误;B.b、c、d分别与a形成的化合物分别是CH4,HF,H2O,根据常温下的状态可知,水的沸点是最高的,另外HF中存在氢键比甲烷的沸点高,故沸点由高到低依次为:d>c>b,正确。C.原子半径由大到小的顺序是Na>Si>C>F>O,正确。D.元素的非金属性由强到弱的序是 F>O >C>Si ,错误。

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
 O和
O和 O中子数相同,质子数不同,互为同位素
O中子数相同,质子数不同,互为同位素 价。
价。 O2 +[O]-Q 平衡常数为K1 ;
O2 +[O]-Q 平衡常数为K1 ;