题目内容
硼酸(H3BO3)大量应用于玻璃制造行业,以硼镁矿(2Mg0.B203.H20、Si02及少量Fe304、CaCO3, Al2O3)为原料生产硼酸的工艺流程如下:
已知:H3BO3在200C、400C、600C、1000C时的溶解度依次为5.0 g、8.7 g、14.8 g、40. 2 g。Fe3 +、Al3+、Fe2 +和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3. 2、 5.2、9.7和 12.4。
(1)由于矿粉中含CaC03,为防止“浸取”时容易产生大量泡沫使物料从反应器中溢出,应采取的措施是: 。
(2)“浸出液”显酸性,含H3B03和Mg2+和SO42-,还含有Fe2+、Fe3+、Ca2+、Al3+等杂质。“除杂”时向浸出液中依次加入适量H202和Mg0,除去的杂质离子是_______。H2O2的作用是____________________________________________ (用离子方程式表示)。
(3)“浸取”后,采用“热过滤”的目的是_____________________________________。
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如下图,且溶 液的沸点随压强增大而升高。为了从“母液”中充分回收MgS04·H20,应采取的 措施是将“母液”蒸发浓缩,____________
(5)硼酸(H3BO3)溶液中存在如下反应:H3BO3(aq)+H2O(l)  [B(OH)4]-(aq)+H+(aq) K=5.7×10-10(298K)
[B(OH)4]-(aq)+H+(aq) K=5.7×10-10(298K)
计算25℃时0.7mol·L-1硼酸溶液中H+的浓度。(写出计算过程)
(6)已知298K时:
| 化学式 | 碳酸 | 醋酸 |
| 电离常数 | K1=4.4×10-7 K2=4.7×10-11 | K=1.75×10-5 |
下列说法正确的是 。
A.碳酸钠溶液滴入硼酸中能观察到有气泡产生
B.碳酸钠溶液滴入醋酸中能观察到有气泡产生

C.等浓度的碳酸和硼酸溶液比较,pH:前者>后者
D.等浓度的碳酸钠和醋酸钠溶液比较,pH:前者>后者
(1)分批慢慢加入稀硫酸 (2分)
(2)Fe3+、Fe2+、Al3+(2分,全对才得分) 2 Fe2+ +2H+ +H2O2 = 2Fe3+ +2H2O(2分)
(3)防止因温度下降时H3BO3从溶液中析出(2分)
(4)加压升温结晶(2分)
(5) H3BO3 (aq)+H2O (l) [B(OH)4]- (aq)+H+(aq)
[B(OH)4]- (aq)+H+(aq)
起始时各物质浓度/ mol·L-1: 0.70 0 0
平衡时各物质浓度/ mol·L-1: 0.70-x x x
K= =
=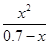 =
=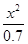 =5.7×10-10
=5.7×10-10
x2=3.99×10-10 x=2×10-5(mol·L-1)
(共4分。两段式1分;K的表达式1分;代入数字的式子1分;结果1分)
(6)BD(2分)
解析试题分析:(1)浸取矿粉时,矿分中含有石灰石,所以如果一次性加入硫酸,会导致CaCO3分解产生大量气泡,所以防止大量气泡产生,可以控制加入硫酸的量来控制反应,所以可以分批慢慢加入硫酸。
(2)含有的Fe2+、Fe3+、Al3+等杂质离子在pH分别为3. 2、 5.2、9.7时沉淀,而Mg2+在12.4沉淀,所以要用Mg0调节pH使杂质离子沉淀,应该先把Fe2+ 氧化为Fe3+ 而沉淀除去,而最终能够沉淀的离子只有Fe2+、Fe3+、Al3+ ,双氧水的作用为把Fe2+ 氧化为Fe3+ ,反应方程式为2 Fe2+ +2H+ +H2O2 = 2Fe3+ +2H2O。
(3)由于H3BO3在水中的溶解度随温度增大而增大,所以要浸取得到更多的产品,应加热浸出液,并采用热过滤的方法过滤,防止因温度降低H3BO3在水中析出。
(4)从图像可以看出,硫酸镁随着温度不同容易形成不同的晶体,而要收集
到的MgS04·H20在较高温度下才结晶,且该晶体的溶解度随温度升高而减小,所以
要在接近200℃的较高温度下得到该晶体,常压下蒸发结晶较难,应该选择加压升温结晶的方法。
(5) H3BO3 (aq)+H2O (l) [B(OH)4]- (aq)+H+(aq)
[B(OH)4]- (aq)+H+(aq)
起始时各物质浓度/ mol·L-1: 0.70 0 0
平衡时各物质浓度/ mol·L-1: 0.70-x x x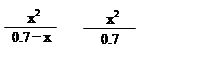 K=
K= = = =5.7×10-10
= = =5.7×10-10
x2=3.99×10-10 x=2×10-5(mol·L-1)
(6)对比硼酸和表格中碳酸、醋酸的电离程度,可知3者的酸性大小为:醋酸>碳酸>硼酸>HCO3-,所以根据酸性大小分析:根据强酸制弱酸原理,碳酸钠溶液滴入硼酸中不能有气泡产生,A错误;碳酸钠溶液滴入醋酸中能观察到有气泡产生 ,B正确;等浓度的碳酸和硼酸溶液比较,碳酸酸性强,pH值小,C错误;等浓度的碳酸钠和醋酸钠溶液比较,碳酸钠水解程度大,碱性强,所以pH大,D正确。故选BD。
,B正确;等浓度的碳酸和硼酸溶液比较,碳酸酸性强,pH值小,C错误;等浓度的碳酸钠和醋酸钠溶液比较,碳酸钠水解程度大,碱性强,所以pH大,D正确。故选BD。
考点:本题考查的是化学工艺流程题,涉及离子的沉淀、晶体的制备、电离平衡常数的计算和应用等知识。

 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案利用硫酸渣(主要含Fe2O3、SiO2、Al2O3、MgO等杂质)制备氧化铁的工艺流程如下: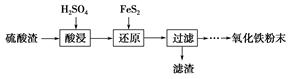
(1)“酸浸”中硫酸要适当过量,目的是:①提高铁的浸出率;②________。
(2)“还原”是将Fe3+转化为Fe2+,同时FeS2被氧化为SO42—,该反应的离子方程式为________________________________________________________________________。
(3)为测定“酸浸”步骤后溶液中Fe3+的量以控制加入FeS2的量。实验步骤为:准确量取一定体积的酸浸后的溶液于锥形瓶中,加入稀盐酸、稍过量SnCl2,再加HgCl2除去过量的SnCl2,以二苯胺磺酸钠为指示剂,用K2Cr2O7标准溶液滴定,有关反应的化学方程式如下:
2Fe3++Sn2++6Cl-=2Fe2++SnCl62—
Sn2++4Cl-+2HgCl2=SnCl62—+Hg2Cl2↓
6Fe2++Cr2O72—+14H+=6Fe3++2Cr3++7H2O
①若SnCl2不足量,则测定的Fe3+量________(填“偏高”、“偏低”或“不变”,下同);
②若不加HgCl2,则测定的Fe3+量________。
(4)①可选用________(填试剂)检验滤液中含有Fe3+。产生Fe3+的原因是________________________________________________________________________(用离子方程式表示)。
②已知部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 3.8 | 7.5 | 9.4 | 8.3 |
| 完全沉淀 | 3.2 | 5.2 | 9.7 | 12.4 | 9.8 |
实验可选用的试剂有:稀硝酸、Ba(NO3)2溶液、酸性KMnO4溶液、NaOH溶液,要求制备过程中不产生有毒气体。
请完成由“过滤”后的溶液模拟制备氧化铁的实验步骤:
a.氧化:________________________________________________________;
b.沉淀:__________________________________________________________;
c.分离,洗涤;
d.烘干,研磨。
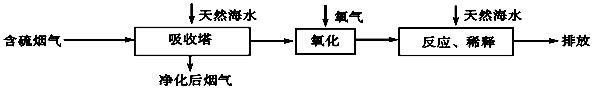
硫酸渣是用黄铁矿制造硫酸过程中排出的废渣,主要化学成分为SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。目前我国已经在技术上取得突破——从硫酸渣中分离出各种成分并加以利用。其流程和相关数据如下: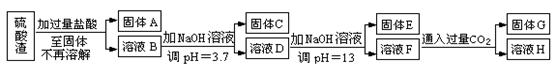
查资料得知:
| 物质名称 | 溶度积(Ksp) | pH值 | |
| 开始沉淀 | 完全沉淀 | ||
| Mg(OH)2 | 5.6×10-12 | 9.3 | 10.8 |
| Fe(OH)3 | 2.8×10-16 | 2.7 | 3.7 |
| Al(OH)3 | 1.3×10-33 | 3.7 | 4.7 |
请回答下列问题:
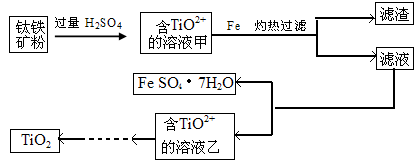
(1)写出固体A的化学式为 。
(2)若要测定溶液的pH是否达到3.7,下列实验用品中可选用的是 。
A.石蕊试液 B.广泛pH试纸 C.精密pH试纸 D.pH计
(3)完成下列离子反应方程式
①溶液D生成固体E ; ②溶液F生成固体G 。
(4)要将固体C、固体E和固体G都转化为相应的稳定氧化物,需进行的实验操作为 。
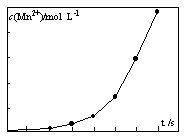
(5)若不考虑溶液体积的变化,请计算溶液H中c(Mg2+)= 。
某科研小组设计出利用工业废酸(10%H2SO4)来堆浸某废弃的氧化铜锌矿(主要成份:CuO ZnO)的方案,实现废物综合利用,方案如下图所示。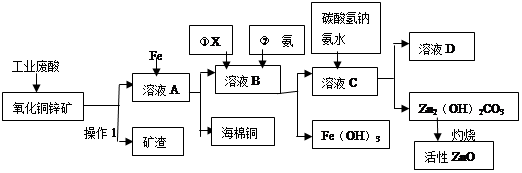
请回答下列问题:
(1)操作1的名称是:
(2)向溶液A中加入Fe粉发生的主要的反应离子方程式为: 、 。
(3)向溶液B中加入物质X的目的是 ,物质X可用下列物质中的 。(填字母)
| A.KMnO4 | B.O2 | C.H2O2 | D.NaOH |
(5)溶液D中主要溶质的化学式是 。
(6)氧化铜锌矿中含有少量的CuS和ZnS,在H2SO4的作用下ZnS可以溶解而CuS不溶,则相同温度下:Ksp(CuS) Ksp(ZnS)(选填“>”“<”或“=”)。

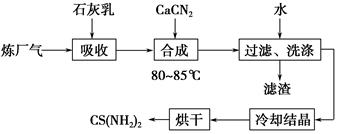
 )具有强氧化性(常被还原为硫酸钾),80 ℃以上易发生分解。实验室模拟工业合成过硫酸钾的流程如下:
)具有强氧化性(常被还原为硫酸钾),80 ℃以上易发生分解。实验室模拟工业合成过硫酸钾的流程如下: