题目内容
根据下图回答问题:?
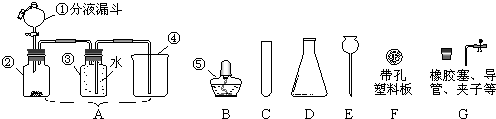
(1)装置气密性的检验须在盛放药品前进行。在上述装置中,往试管B、C、D中各加入5 mL蒸馏水封住导管口,各连接处都紧密而不漏气的情况下,点燃酒精灯,微热带支管的试管一会儿,试管B、C、D中未出现气泡;熄灭酒精灯后,试管B、C、D中导管内水面也未上升,其原因是: 。?
(2)①一般来说,硫酸的质量分数大于60%,就具有一定的氧化性,且越浓氧化性越强;②温度也要影响氧化性,如铜放于冷的浓硫酸中反应不明显,加热就可观察到明显现象。?
甲同学利用上述装置,用实验来验证硫酸氧化性的上述结论(已知98%的浓硫酸的密度为
1.84 g·cm -3)。他先向试管B加入5 mL品红试液,向试管C、D中各加入5 mL饱和澄清石灰水;向带支管的试管中放入铜粉和3 mL水,然后从分液漏斗向支管试管中滴加98%的浓硫酸10滴(约0.5 mL),加热至沸腾,这时支管试管中溶液颜色是否有明显变化 (填“无”或“有”),试用数据解释其原因 ;该同学用分液漏斗再向支管试管中加98%的浓硫酸10 mL,并加热至沸腾,观察到的现象分别是:支管试管中 ,B试管中 。?
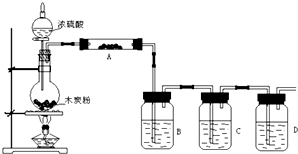
(3)乙同学利用上述装置来检验浓硫酸和木炭粉在加热条件下发生反应的全部产物。?
①浓硫酸和木炭粉在加热条件下发生反应的化学方程式为: 。?
②要达此目的,则:?
A中加入试剂的名称是,作用是 ;?
B中加入试剂的名称是,作用是 ;?
C中加入试剂的名称是,作用是 ;?
D中加入试剂的名称是,作用是 。
(1)分液漏斗的活塞未关闭?
(2)无此时硫酸的质量分数为23%,小于60%,其氧化性弱,所以无明显现象
铜粉上产生气泡,溶液渐成蓝色试管B中品红褪色?
(3)①2H2SO4(浓) + C![]() CO2↑+ 2SO2↑+ 2H2O?
CO2↑+ 2SO2↑+ 2H2O?
②无水硫酸铜检验H2O品红溶液检验SO2足量KMnO4酸性溶液
除尽SO2澄清石灰水检验CO2?
解析:(1)这些现象说明有漏气,但试题中说明“不漏气”,则只有漏斗活塞未关闭。?
(2)判断溶液颜色有无变化,实际上就是是否被氧化,必须计算看其质量分数是否达到60%,结果是23%。?
(3)检验SO2与CO2均需用水溶液,所以第一步要检验水,用无水CuSO4;SO2与CO2相比更有特点(还原性、漂白性),所以先检验SO2,用KMnO4溶液(酸性)或品红试液;最后检验CO2。