题目内容
事实上,许多氧化物在一定条件下能与Na2O2反应,且反应极有规律,如Na2O2+SO2=Na2SO4,2Na2O2+2SO3=2Na2SO4+O2,据此你认为下列反应方程式中不正确的是( )
| A.Na2O2+N2O3=NaNO2+NaNO3 |
| B.Na2O2+2NO2=2NaNO2+O2 |
| C.Na2O2+N2O4=2NaNO3 |
| D.2Na2O2+2Mn2O7=4NaMnO4+O2 |
B
解析

练习册系列答案
 夺冠金卷全能练考系列答案
夺冠金卷全能练考系列答案
相关题目
现有稀硫酸和稀硝酸的混合溶液,已知其中稀硫酸浓度为4mol/L,稀硝酸的浓度为2mol/L。取10mL混合酸,向其中加入过量铁粉,反应结束后,在标准状况下可收集到气体体积为(假设HNO3只被还原为NO)
| A.0.224L | B.0.448L | C.0.672L | D.0.896L |
下列类推正确的是 ( )。
| A.CaCO3与稀硝酸反应生成CO2,CaSO3也能与稀硝酸反应生成SO2 |
| B.铜在氯气中剧烈燃烧生成二价铜,铜也能在硫蒸气中剧烈燃烧生成二价铜 |
| C.锌可以与溶液中的银离子发生置换反应,钠也能与溶液中的银离子发生置换反应 |
| D.钠与乙醇反应产生氢气,钾与乙醇也能反应产生氢气 |
向酸化过的MnSO4溶液中滴加(NH4)2S2O8(过二硫酸铵)溶液会发生反应:Mn2++S2O82-+H2O―→MnO4-+H++SO42-。下列说法不正确的是( )
| A.可以利用该反应检验Mn2+ |
| B.氧化性比较:S2O82->MnO4- |
| C.MnSO4溶液可以使用盐酸酸化 |
| D.若有0.1 mol氧化产物生成,则转移电子0.5 mol |
工业上可用硫酸铝与硫磺焙烧制备氧化铝:2Al2(SO4)3+3S 2Al2O3+9SO2↑,下列有关说法中正确的是( )
2Al2O3+9SO2↑,下列有关说法中正确的是( )
| A.反应中Al2(SO4)3被氧化 |
| B.Al2 (SO4)3、Al2O3均含有离子键和共价键 |
| C.5.1 g Al2O3含有9.03×1022个阴离子 |
| D.该反应中,每转移0.3 mol电子生成5.04 L SO2 |
二氧化氯(ClO2)是一种广谱、高效的消毒剂,易溶于水,尤其在水处理等方面有广泛应用。以下是某校化学研究小组设计实验室制取ClO2的工艺流程图。下列有关说法正确的是( )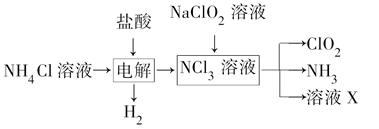
A.电解时发生反应的化学方程式为2HCl Cl2↑+H2↑ Cl2↑+H2↑ |
| B.由NaClO2溶液制取0.6 mol ClO2时,至少消耗0.1 mol NCl3 |
| C.将产生的混合气体通过盛有碱石灰的干燥器以除去ClO2中的NH3 |
| D.溶液X的主要成分为NaClO2和NaOH |
下列工业生产的反应原理不涉及氧化还原反应的是( )
| A.钢铁厂高炉炼铁 |
| B.工业上以氨气为原料用氨碱法生产纯碱 |
| C.硝酸厂以氨气为原料制取硝酸 |
| D.氯碱厂利用氯化钠生产氯气和烧碱 |
黄铜矿(CuFeS2)常用于提炼金属铜。黄铜矿焙烧过程中所发生的反应比较复杂,其中主要反应之一的化学方程式为2CuFeS2+O2
 +2FeS+SO2(已配平),则下列关于该反应的说法错误的是( )。
+2FeS+SO2(已配平),则下列关于该反应的说法错误的是( )。
| A.方框中的物质应为CuS |
| B.该反应的部分产物可用于硫酸工业 |
| C.反应中SO2既是氧化产物又是还原产物 |
| D.反应中若有1 mol SO2生成,则一定有4 mol电子发生转移 |
 LiNH2+2LiH,氧化产物为 (填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的 %(精确到0.1)。
LiNH2+2LiH,氧化产物为 (填化学式)。在270℃时,该反应可逆向发生放出H2,因而氮化锂可作为储氢材料,储存氢气最多可达Li3N质量的 %(精确到0.1)。 FePO4之间的转化,电池放电时负极发生的反应为Li
FePO4之间的转化,电池放电时负极发生的反应为Li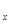 C6-
C6-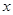 e—
e—