题目内容
19.短周期元素A、B、C、D的原子序数依次增大,原子半径r(C)>r(D)>r(B)>r(A).B原子最外层电子数是其内层电子总数的3倍,D原子的核电荷数等于A、C原子核电荷数之和,A与C同主族.下列说法正确的是( )| A. | 工业上常用电解熔融D的氧化物来制备D的单质 | |
| B. | 单质C、D着火,灭火时C不能用泡沫灭火器,但D可以用泡沫灭火器灭火 | |
| C. | 化合物A2B2与C2B2所含化学键类型完全相同 | |
| D. | A、B、C组成的化合物,若溶液浓度为0.01mol/L,则常温下其PH为12 |
分析 短周期元素A、B、C、D的原子序数依次增大,原子半径rC>rD>rB>rA.B原子最外层电子数是其内层电子总数的3倍,则B为O元素;A与C同主族,D原子的核电荷数等于A、C原子核电荷数之和,则C、D同在第三周期,由于A的半径小于O的半径,所以A只能为H或F,若A为H、C为Na,则D为Mg,若A为F、C为Cl,则D为Fe,不符合,
综上可知,A为H,B为O,C为Na,D为Mg,然后结合元素化合物性质及元素周期律来解答.
解答 解:短周期元素A、B、C、D的原子序数依次增大,原子半径rC>rD>rB>rA.B原子最外层电子数是其内层电子总数的3倍,则B为O元素;A与C同主族,D原子的核电荷数等于A、C原子核电荷数之和,则C、D同在第三周期,由于A的半径小于O的半径,所以A只能为H或F,若A为H、C为Na,则D为Mg,若A为F、C为Cl,则D为Fe,不符合,综上可知,A为H,B为O,C为Na,D为Mg,
A.D为Mg,工业用电解氯化镁的方法冶炼镁,故A错误;
B.D为Mg,能与二氧化碳反应,所以单质Mg着火时,不可用二氧化碳灭火器灭火,C为Na,钠燃烧生成过氧化钠,能与二氧化碳生成氧气,助燃,所以不能用泡沫灭火器灭火,故B错误;
C.化合物H2O2与Na2O2所含化学键分别为共价键、离子键,故C错误;
D.A、B、C组成的化合物NaOH溶液,25℃时若溶液浓度为0.01mol/L,则溶液中氢离子浓度为10-12mol/L,则pH=12,故D正确.
故选D.
点评 本题考查原子结构与元素周期律知识,题目难度中等,本题注意根据离子的电子层结构判断元素在周期表中的位置,结合元素周期律的递变规律进行判断.

练习册系列答案
相关题目
14.下列说法正确的是( )
| A. | KClO3 和SO3 溶于水后能导电,故KClO3和SO3为电解质 | |
| B. | 25℃时、用醋酸溶液滴定等浓度NaOH 溶液至pH=7,V醋酸<VNaOH | |
| C. | 向NaAlO2 溶液中滴加NaHCO3 溶液,有沉淀和气体生成 | |
| D. | AgCl 易转化为AgI 沉淀且K(AgX)=c(Ag+ )•c(X-),故K(AgI)<K(AgCl) |
11.下列离子方程式书写正确的是( )
| A. | 用稀HNO3溶液溶解FeS固体:FeS+2H+═Fe2++H2S | |
| B. | Fe2(SO4)3的酸性溶液中通过足量硫化氢:2Fe3++H2S═2Fe2++S↓+2H+ | |
| C. | 少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-═CaSO3+2HClO | |
| D. | 酸性条件下KIO3溶液与KI溶液反应生成I2:IO3-+5I-+3H2O═3I2+6OH- |
8.浓硫酸、稀硫酸分别与下列物质混合时,开始反应的本质肯定不同的是( )
| A. | Na2SO3 | B. | Fe(OH)3 | C. | Na2O | D. | Zn |
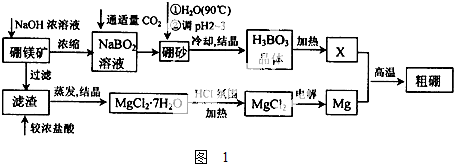
 )的废水可以利用微生物电池除去,其原理如图2所示.
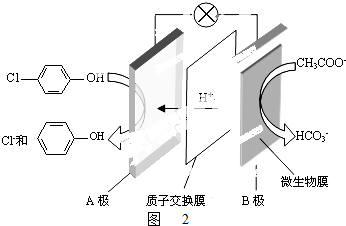
)的废水可以利用微生物电池除去,其原理如图2所示.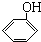 +Cl-.
+Cl-.