题目内容
【题目】如图为相互串联的三个装置,试回答:
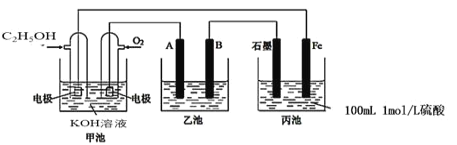
(1)写出甲池负极的电极反应式:________。
(2)若甲池消耗4.6gC2H5OH气体,则丙池中石墨极上生成气体的物质的量为______,反应一段时间后丙池溶液pH_______(填“增大”、“减小”、“不变”)。
(3)若利用乙池在铁片上镀银,则B是_______(填电极材料),电极反应式是______。
(4)若乙池中A、B为石墨电极,电解质溶液为CuCl2。当丙池共产生6.72L(标况)气体时,乙池A极产物_____mol,检验该产物的方法为:______(简述操作)。
【答案】C2H5OH-12e-+16OH-=2CO32-+11H2O 0.3mol 减小 Fe Ag++e-=Ag 0.2 用湿润的淀粉碘化钾试纸靠近A极,若变蓝,说明所产生气体为Cl2
【解析】
(1)在燃料电池中,通入燃料的电极为负极;
(2)与燃料电极连接的为阴极,与O2电极连接的为阳极,在丙池的石墨电极为阳极,溶液中OH-失去电子,发生氧化反应产生O2。先计算乙醇的物质的量,根据其失去电子,结合同一闭合回路中电子转移数目相等,可计算出反应产生氧气的物质的量,结合水的电离平衡判断溶液pH变化;
(3)在铁片上镀银,金属铁作阴极,金属银作阳极材料,选择硝酸银为电解质溶液;
(4)丙池实质是电解水,反应式为2H2O![]() 2H2↑+O2↑,根据气体的体积计算其物质的量,结合方程式确定转移电子数目,在乙池中A电极为阳极,在阳极上产生氯气,利用电子守恒解答,并根据氯气的强氧化性进行检验。
2H2↑+O2↑,根据气体的体积计算其物质的量,结合方程式确定转移电子数目,在乙池中A电极为阳极,在阳极上产生氯气,利用电子守恒解答,并根据氯气的强氧化性进行检验。
(1)在甲池中通入乙醇的电极为负极,乙醇失去电子,被氧化,与溶液中的OH-结合形成CO32-,所以负极的电极反应式为C2H5OH-12e-+16OH-=2CO32-+11H2O;
(2)在丙池中,石墨电极与燃料电池的正极连接,为阳极,Fe电极为阴极。在石墨电极上发生反应:4OH--4e-=2H2O+O2↑,n(C2H5OH)=4.6g÷46g/mol=0.1mol,根据负极的电极反应式C2H5OH-12e-+16OH-=2CO32-+11H2O可知:1mol乙醇反应失去12mol电子,则0.1mol乙醇反应失去1.2mol电子,由于在同一闭合回路中电子转移数目相等,所以丙池中石墨电极上反应产生O2的物质的量是n(O2)=1.2mol÷4=0.3mol;由于溶液中OH-不断放电产生O2,破坏了水的电离平衡,促进了水的电离,使溶液中c(H+)增大,溶液的酸性会逐渐增强,因此反应一段时间后丙池溶液pH减小;
(3)若利用乙池在铁片上镀银,则金属铁是阴极材料,与电源的负极连接,金属银是阳极材料,与电源的正极连接,选择硝酸银为电解质溶液。在甲池中,通氧气的电极是正极,所以乙池中A是阳极,材料是银,B是阴极,材料是铁片,在B电极上发生的电极反应:Ag++e-=Ag;
(4)乙池中A是阳极,发生反应:2Cl- -2e-=Cl2↑,B是阴极,Cu2+获得电子变为单质Cu。丙池共产生标况6.72L气体时,n(气体)=6.72L÷22.4L/mol=0.3mol,在丙池中实质是电解水,方程式是:2H2O![]() 2H2↑+O2↑。根据方程式可知:每反应产生3mol气体,转移电子的物质的量是4mol,则反应产生0.3mol气体,转移电子的物质的量是0.4mol,则根据串联电路中电子转移数目相等,可知在乙池的A电极上反应得到的氯气的物质的量是0.4mol÷2=0.2mol。氯气具有强的氧化性,在溶液中可将I-氧化为I2,I2遇淀粉溶液变为蓝色,故检验氯气的方法是:用湿润的淀粉碘化钾试纸靠近A极,若变蓝,说明所产生气体为Cl2。
2H2↑+O2↑。根据方程式可知:每反应产生3mol气体,转移电子的物质的量是4mol,则反应产生0.3mol气体,转移电子的物质的量是0.4mol,则根据串联电路中电子转移数目相等,可知在乙池的A电极上反应得到的氯气的物质的量是0.4mol÷2=0.2mol。氯气具有强的氧化性,在溶液中可将I-氧化为I2,I2遇淀粉溶液变为蓝色,故检验氯气的方法是:用湿润的淀粉碘化钾试纸靠近A极,若变蓝,说明所产生气体为Cl2。

 阅读快车系列答案
阅读快车系列答案