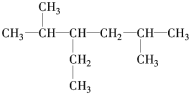
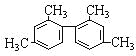
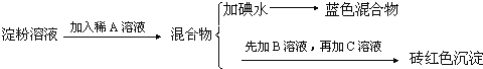
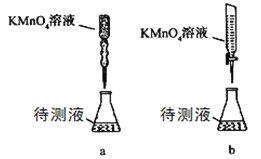
题目内容
【题目】化石燃料开采、加工过程中会产生剧毒气体硫化氢(H2S),可通过间接电化学法除去,其原理如图所示。下列说法错误的是
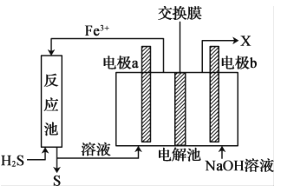
A.反应池中处理硫化氢的反应是H2S+2Fe3+=2Fe2++S↓+2H+
B.电极a为阳极,电极b为阴极
C.若交换膜为质子(H+ )交换膜,则NaOH溶液的浓度逐渐变大
D.若交换膜为阳离子交换膜,b电极区会产生红褐色沉淀
【答案】C
【解析】
A. 由图示知反应池中,Fe3+与硫化氢发生氧化还原反应,反应的离子方程式为:H2S+2Fe3+=2Fe2++S↓+2H+,故A正确;
B.a极产生Fe3+,发生氧化反应,所以为阳极,b为阴极,故B正确;
C. 若交换膜为质子交换膜,则H+进入b极,则NaOH溶液的浓度逐渐变小,故C错误
D. 若交换膜为阳离子交换膜,Fe3+会向阴极移动,与氢氧根离子生成红褐色Fe(OH)沉淀3,故D正确;
故选C。

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案【题目】某化学兴趣小组为研究过氧化钠与SO2的反应情况,进行如下探究。
(1)[提出假设]
向一定量的过氧化钠固体中通入足量的SO2,对反应后的固体产物成分及反应原理提出如下假设:
假设一:反应后固体中只有Na2SO3,证明SO2未被氧化;
假设二:反应后固体中只有Na2SO4,证明SO2完全被氧化;
假设三:反应后固体______,证明SO2部分被氧化。
(2)[定性研究]
为验证假设三,该小组进行如下研究,请你完成下表中内容。
实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
取适量反应后的固体放入试管中,____ | ______ |
(3)[定量研究]
通过测量气体的体积判断发生的化学反应,实验装置如图:

①装置B中所盛装试剂的名称为________。
②装置D的作用是__________。
③请画出实验装置E_____。
④实验测得装置C中过氧化钠质量增加了m1 g,装置D质量增加了m2 g,装置E中收集到的气体为V L(已换算成标准状况下),用上述有关测量数据进行填表判断。
SO2被氧化的程度 | V与m1或m2的关系 |
未被氧化 | |
完全被氧化 | V=0 |
部分被氧化 | _____ |