题目内容
【题目】1918年,Lewis提出反应速率的碰撞理论:反应物分子间的相互碰撞是反应进行的必要条件,但并不是每次碰撞都能引起反应,只有少数碰撞才能发生化学反应.能引发化学反应的碰撞称之为有效碰撞.

(1)图I是HI分解反应中HI分子之间的几种碰撞示意图,其中属于有效碰撞的是(选填“A”、“B”或“C”);
(2)20世纪30年代,Eyring和Pelzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态.
图Ⅱ是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:;
(3)过渡态理论认为,催化剂改变反应速率的原因是改变了反应的途径,对大多数反应而言主要是通过改变过渡态而导致有效碰撞所需要的能量发生变化.请在图Ⅱ中作出NO2和CO反应时使用催化剂而使反应速率加快的能量变化示意图;
【答案】
(1)C
(2)NO2(g)+CO(g)=CO2(g)+NO(g)△H=﹣234kJ/mol
(3)
【解析】(1)只有发生化学反应的碰撞才是有效碰撞,分析三个图,可知只有C有新物质生成,则C为有效碰撞,所以答案是:C;(2)反应热为134kJ/mol﹣368kJ/mol=﹣234kJ/mol,则反应的热化学方程式为NO2(g)+CO(g)=CO2(g)+NO(g)△H=﹣234 kJ/mol;(3)加入
催化剂,降低反应物的活化能,反应速率加快,图象应为 :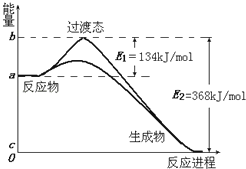 ;
;
【考点精析】本题主要考查了反应热和焓变的相关知识点,需要掌握在化学反应中放出或吸收的热量,通常叫反应热才能正确解答此题.

练习册系列答案
相关题目