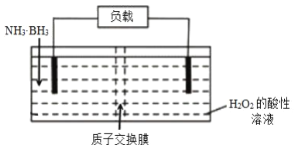
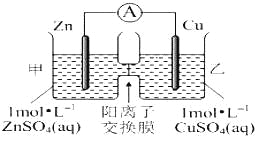
题目内容
【题目】下列实验过程中产生沉淀的物质的量(Y)与加入试剂的物质的量(X)之间的关系正确的是( )
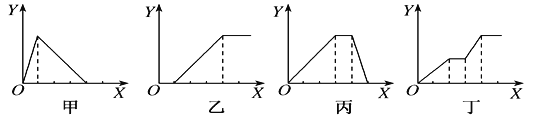
A. 甲向AlCl3溶液中逐滴加入NaOH溶液至过量且边滴边振荡
B. 乙向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡
C. 丙向NH4Al(SO4)2溶液中逐滴加入NaOH溶液直至过量
D. 丁向NaOH、Ba(OH)2、NaAlO2的混合溶液中逐渐通入CO2至过量
【答案】C
【解析】
A.向AlCl3溶液中逐滴加入NaOH溶液至过量且边滴边振荡,先产生氢氧化铝沉淀:AlCl3+3NaOH=Al(OH)3↓+3NaCl,继续滴加NaOH溶液,Al(OH)3和NaOH溶液反应,生成偏铝酸钠,沉淀溶解:NaOH+ Al(OH)3=NaAlO2+2H2O,所以沉淀量达到最大消耗NaOH和沉淀溶解消耗NaOH的比为3:1;A错误;
B.向NaAlO2溶液中滴加稀盐酸,立刻产生白色氢氧化铝沉淀,发生反应:AlO2-+H++H2O= Al(OH)3↓,随着盐酸的逐滴加入,开始形成的沉淀又逐渐溶解,发生反应:Al(OH)3+3H+=Al3++3H2O,所以沉淀量达到最大消耗的盐酸和沉淀完全溶解消耗的盐酸的物质的量之比是1:3.B错误;
C.向NH4Al(SO4)2溶液中逐滴加入氢氧化钠溶液,开始滴加NaOH发生反应为Al3++3OH-= Al(OH)3↓,先产生氢氧化铝沉淀,当Al3+沉淀完全后,然后发生反应NH4++OH-=NH3H2O;此时沉淀氢氧化铝的量不变,最后继续滴加NaOH,发生反应Al(OH)3+OH-=AlO2-+2H2O,氢氧化铝沉淀溶解,沉淀量达到最大消耗NaOH、沉淀量不变和沉淀溶解消耗NaOH的比为3:1:1;C正确;
D.向NaOH、Ba(OH)2、NaA1O2的混合溶液中逐渐通入二氧化碳至过量,首先发生反应:Ba(OH)2+CO2=BaCO3↓+H2O,产生白色沉淀,然后发生:CO2+2NaOH=Na2CO3+H2O,此时沉淀的量不变,再发生反应2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO3,产生沉淀,又发生反应:CO32-+H2O+CO2=2HCO3-,BaCO3+H2O+CO2=Ba(HCO3)2, CO32-+H2O+CO2=2HCO3-,BaCO3+H2O+CO2=Ba(HCO3)2,Na2CO3+H2O+CO2=2NaHCO3沉淀量不变,最后发生反应:BaCO3+2H2O+2CO2=Ba(HCO3)2,沉淀部分溶解,D错误;
故合理选项是C。

 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案【题目】醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如下:
![]()
![]()
![]() +H2O
+H2O

可能用到的有关数据如下:
相对分子质量 | 密度/(gcm﹣3) | 沸点/℃ | 溶解性 | |
环己醇 | 100 | 0.961 8 | 161 | 微溶于水 |
环己烯 | 82 | 0.810 2 | 83 | 难溶于水 |
合成反应:
在a中加入20g环己醇和2小片碎瓷片,冷却搅动下慢慢加入1mL浓硫酸.b中通入冷却水后,开始缓慢加热a,控制馏出物的温度不超过90℃.
分离提纯:
反应粗产物倒入分液漏斗中分别用少量5%碳酸钠溶液和水洗涤,分离后加入无水氯化钙颗粒,静置一段时间后弃去氯化钙.最终通过蒸馏得到纯净环己烯10g.
回答下列问题:
(1)装置b的名称是__________.
(2)加入碎瓷片的作用是_________;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是________(填正确答案标号).
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
(3)本实验中最容易产生的副产物的结构简式为________________________.
(4)分液漏斗在使用前须清洗干净并__________;在本实验分离过程中,产物应该从分液漏斗的______________(填“上口倒出”或“下口放出”).
(5)分离提纯过程中加入无水氯化钙的目的是_______________.
(6)在环己烯粗产物蒸馏过程中,不可能用到的仪器有______(填正确答案标号).
A.蒸馏烧瓶 B.温度计 C.吸滤瓶 D.冷凝管 E.接收器
(7)本实验所得到的环己烯产率是________(填正确答案标号).
A.41% B.50% C.61% D.70%
【题目】已知X、Y、Z、W均为中学化学中常见的单质或化合物,它们之间的转化关系如图所示(部分产物已略去)。则W、X不可能是( )

选项 | W | X |
A | 稀硫酸 | NaAlO2溶液 |
B | 稀硝酸 | Fe |
C | CO2 | Ca(OH)2溶液 |
D | Cl2 | Fe |
A. A B. B C. C D. D