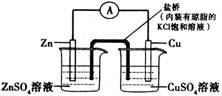
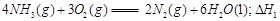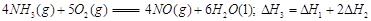题目内容
下列表述中,合理的是( )
分析:A.应用酸式滴定管量取高锰酸钾溶液;
B.加热促进水的电离,结合pH与氢离子的关系判断;
C.根据阳离子的放电顺序判断;
D.从影响盐类水解的因素分析.
B.加热促进水的电离,结合pH与氢离子的关系判断;
C.根据阳离子的放电顺序判断;
D.从影响盐类水解的因素分析.
解答:解:A.高锰酸钾具有氧化性,可腐蚀橡胶管,应用酸式滴定管量取,故A错误;
B.加热促进水的电离,Kw增大,溶液氢离子浓度增大,则pH减小,故B错误;
C.Ag+氧化性大于Cu2+,1L浓度均为2mol/L的AgNO3与Cu(NO3)2的混合溶液,当有0.2mol电子转移时,首先析出Ag,质量为0.2mol×108g/mol=21.6g,故C错误;
D.由于(NH4)2CO3为弱酸弱碱盐,NH4+和CO32-发生互促水解,c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液,应存在c[(NH4)2SO4]<c[(NH4)2CO3],c(NH4+)相等时,NH4Cl溶液浓度最大,故D正确.
故选D.
B.加热促进水的电离,Kw增大,溶液氢离子浓度增大,则pH减小,故B错误;
C.Ag+氧化性大于Cu2+,1L浓度均为2mol/L的AgNO3与Cu(NO3)2的混合溶液,当有0.2mol电子转移时,首先析出Ag,质量为0.2mol×108g/mol=21.6g,故C错误;
D.由于(NH4)2CO3为弱酸弱碱盐,NH4+和CO32-发生互促水解,c(NH4+)相等的(NH4)2SO4溶液、(NH4)2CO3溶液,应存在c[(NH4)2SO4]<c[(NH4)2CO3],c(NH4+)相等时,NH4Cl溶液浓度最大,故D正确.
故选D.
点评:本题考查较为综合,涉及实验基本操作、弱电解质的电离、电解以及盐类的水解,题目难度中等,本题中注意把握阳离子的放电顺序.

练习册系列答案
相关题目
下列表述中,合理的是( )
| A、将水加热,Kw增大,pH不变 | B、把FeCl3的水溶液加热蒸干可得到FeCl3固体 | C、用25 mL碱式滴定管量取20.00mL高锰酸钾溶液 | D、用惰性电极电解足量的AgNO3溶液时,当有0.2 mole-转移时会析出21.6g银 |