题目内容
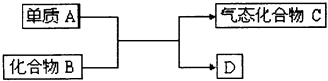
【题目】如图是一些重要工业生产的转化关系(反应条件略去):请完成下列问题: 
(1)若D是单质,且与A属于同一主族,反应在高温下进行,则: ①此反应的化学方程式是 .
②D单质的一种重要用途是 .
(2)若B为黄色固体,D为固体化合物,则该反应为4FeS2+11O2 ![]() 2Fe2O3+8SO2①当有1molC生成时,该反应转移电子的总数是 .
2Fe2O3+8SO2①当有1molC生成时,该反应转移电子的总数是 .
②将C通入足量的酸性KMnO4 溶液中,发生反应的离子方程式为 .
(3)若B是一种碱性气体,D为化合物,则: ①该反应的化学方程式是 .
②B在加热条件下与CuO反应有Cu生成,该反应的化学方程式为;有人提出产物Cu中可能还含有Cu2O.已知Cu+在酸性溶液中不能稳定存在,为验证Cu2O是否存在,可取少量反应产物,滴加足量稀硫酸,若溶液由无色变为蓝色,则证明含有Cu2O.请写出发生反应的化学方程式: .
【答案】
(1)2C+SiO2 ![]() 2CO+Si;制半导体材料
2CO+Si;制半导体材料
(2)3.31×1024;2MnO4﹣+5SO2+2H2O═2Mn2++5SO42﹣+4H+
(3)4NH3+5O2 ![]() 4NO+6H2O;2NH3+3CuO
4NO+6H2O;2NH3+3CuO ![]() 3Cu+N2↑+3H2O;Cu2O+H2SO4=Cu+CuSO4+H2O
3Cu+N2↑+3H2O;Cu2O+H2SO4=Cu+CuSO4+H2O
【解析】解:(1)D与A同主族,A能置换出D,且该反应是重要反应,则分析元素周期表,可知A是C,D是Si,即2C+SiO2 ![]() 2CO+Si,硅单质的一种重要用途是制半导体材料, 故答案为:2C+SiO2
2CO+Si,硅单质的一种重要用途是制半导体材料, 故答案为:2C+SiO2 ![]() 2CO+Si;制半导体材料;(2)若B为黄色固体,D为固体化合物,则该反应为4FeS2+11O2
2CO+Si;制半导体材料;(2)若B为黄色固体,D为固体化合物,则该反应为4FeS2+11O2 ![]() 2Fe2O3+8SO2①生成8molSO2电子转移44mol,当有1molSO2生成时,该反应转移电子的总数=
2Fe2O3+8SO2①生成8molSO2电子转移44mol,当有1molSO2生成时,该反应转移电子的总数= ![]() mol×6.02×1023=3.31×1024 ,
mol×6.02×1023=3.31×1024 ,
故答案为:3.31×1024;②二氧化硫具有还原性,能被高锰酸钾溶液氧化为硫酸,反应的离子方程式为:2MnO4﹣+5SO2+2H2O═2Mn2++5SO42﹣+4H+ ,
故答案为:2MnO4﹣+5SO2+2H2O═2Mn2++5SO42﹣+4H+;(3)若B是一种碱性气体为NH3 , D为化合物为H2O,是氨气的催化氧化反应生成一氧化氮和水,
①反应为氨气的催化氧化反应,氨气和氧气反应生成一氧化氮和水,反应的化学方程式为:4NH3+5O2 ![]() 4NO+6H2O,
4NO+6H2O,
故答案为:4NH3+5O2 ![]() 4NO+6H2O;
4NO+6H2O;
②B在加热条件下与CuO反应有Cu生成,氨气具有还原性和氧化铜发生氧化还原反应生成氮气、铜和水,反应的化学方程式为:2NH3+3CuO ![]() 3Cu+N2↑+3H2O,已知Cu+在酸性溶液中不能稳定存在,为验证Cu2O是否存在,可取少量反应产物,滴加足量稀硫酸,若溶液由无色变为蓝色,说明氧化亚铜在酸溶液中发生歧化反应生成铜和硫酸铜,则证明含有Cu2O,反应的化学方程式为:Cu2O+H2SO4=Cu+CuSO4+H2O,
3Cu+N2↑+3H2O,已知Cu+在酸性溶液中不能稳定存在,为验证Cu2O是否存在,可取少量反应产物,滴加足量稀硫酸,若溶液由无色变为蓝色,说明氧化亚铜在酸溶液中发生歧化反应生成铜和硫酸铜,则证明含有Cu2O,反应的化学方程式为:Cu2O+H2SO4=Cu+CuSO4+H2O,
故答案为:2NH3+3CuO ![]() 3Cu+N2↑+3H2O,Cu2O+H2SO4=Cu+CuSO4+H2O;
3Cu+N2↑+3H2O,Cu2O+H2SO4=Cu+CuSO4+H2O;
(1)根据常见的置换反应,A、D同主族及工业制取硅的化学反应分析,是碳还原二氧化硅生成硅和一氧化碳的反应;(2)若B为黄色固体,D为固体化合物,则该反应为4FeS2+11O2 ![]() 2Fe2O3+8SO2 ,
2Fe2O3+8SO2 ,
①标注元素化合价变化结合电子守恒计算电子转移,化学方程式中每生成8molSO2电子转移44mol;
②将二氧化硫通入足量的酸性KMnO4 溶液中发生氧化还原反应,生成硫酸;(3)若B是一种碱性气体为NH3 , D为化合物为H2O,是氨气的催化氧化反应生成一氧化氮和水,根据工业氨气催化氧化制取硝酸分析,
①反应为氨气的催化氧化生成一氧化氮和水;
②氨气和氧化铜反应生成铜、氮气和水,氧化亚铜在稀硫酸溶液中发生歧化反应生成铜、硫酸铜;

 智慧小复习系列答案
智慧小复习系列答案