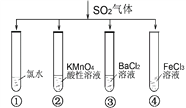
题目内容
【题目】Na2S2O35H2O在化学定量分析中常用作基准物质,实验室制备原理为Na2S + Na2CO3 + 4SO2 ![]() 3Na2S2O3 + CO2。现设计如下装置(夹持仪器省略)进行实验。
3Na2S2O3 + CO2。现设计如下装置(夹持仪器省略)进行实验。

(1)A中发生反应的化学方程式为_______________________________。
(2)C中所盛试剂可能是_______________;若要停止A中的化学反应,除取下酒精灯加热外,还可以采取的操作是__________________________。
(3)甲同学在加热A后,发现液面下的铜丝变黑。该同学对黑色生成物提出如下假设:
① 可能是CuO; ② 可能是Cu2O; ③ 可能是CuS
乙同学认为假设②一定不成立,依据是__________;该同学设计如下实验进一步验证黑色物质的组成:
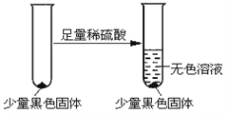
基于上述假设分析,黑色物质的组成为________(填化学式)。
(4)实验室用Na2S2O3标准溶液测定废水中Ba2+ 的浓度,过程如下:(已知:2S2O32-+I2==S4O62-+2I-)。
![]()
① 写出BaCrO4沉淀与过量HI、HCl溶液反应的离子方程式:________;
② 若以淀粉为指示剂,则达到滴定终点时的现象是__________________。
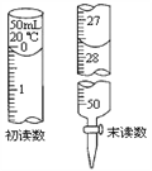
③ 若Na2S2O3标准溶液的浓度为0.0030 molL-1,消耗该Na2S2O3标准溶液的体积如图所示,则废水中Ba2+ 的浓度为___________。
【答案】Cu+2H2SO4![]() CuSO4+SO2↑+2H2ONaOH溶液将铜丝抽离液面Cu2O是砖红色沉淀CuS2BaCrO4+6I-+16H+=3I2+2Cr3++2Ba2++8H2O淀粉溶液由蓝色变为无色,且半分钟内不变色0.0011mol/L或1.1×10-3 mol/L
CuSO4+SO2↑+2H2ONaOH溶液将铜丝抽离液面Cu2O是砖红色沉淀CuS2BaCrO4+6I-+16H+=3I2+2Cr3++2Ba2++8H2O淀粉溶液由蓝色变为无色,且半分钟内不变色0.0011mol/L或1.1×10-3 mol/L
【解析】
由题中信息可知,A为制备二氧化硫气体的装置,B为制备硫代硫酸钠的装置,C为尾气处理装置。
(1)A中发生反应的化学方程式为Cu+2H2SO4![]() CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
(2)C的作用是吸收尾气中的二氧化硫气体,防止污染空气。二氧化硫是一种酸性氧化物,故其中所盛试剂可能是NaOH溶液;若要停止A中的化学反应,除取下酒精灯加热外,还可以采取的操作是将铜丝抽离液面。
(3)甲同学在加热A后,发现液面下的铜丝变黑。该同学对黑色生成物提出如下假设:
① 可能是CuO; ② 可能是Cu2O; ③ 可能是CuS
乙同学认为假设②一定不成立,依据是Cu2O是砖红色沉淀;
由图中信息可知,黑色物质不溶于稀硫酸中,基于上述假设分析,黑色物质的组成为CuS。
(4)实验室用Na2S2O3标准溶液测定废水中Ba2+ 的浓度,过程如下:(已知:2S2O32-+I2==S4O62-+2I-)。
![]()
由上述实验流程可知,废水中加入足量的重铬酸钾溶液把其中的钡离子沉淀为铬酸钡,过滤,再用HI和稀盐酸把沉淀溶解,最后加入硫代硫酸钠溶液滴定。
① BaCrO4沉淀与过量HI、HCl溶液反应的离子方程式为:2BaCrO4+6I-+16H+=3I2+2Cr3++2Ba2++8H2O;
② 滴定终点时,碘转化为碘离子,若以淀粉为指示剂,则达到滴定终点时的现象是:淀粉溶液由蓝色变为无色,且半分钟内不变色。
③ 由图可知,消耗该Na2S2O3标准溶液的体积为27.50mL,若Na2S2O3标准溶液的浓度为0.0030 molL-1,由化学方程式及电子转移守恒可知,n(Ba2+)=![]() ,则废水中Ba2+ 的浓度为
,则废水中Ba2+ 的浓度为![]() 1.1×10-3 mol/L。
1.1×10-3 mol/L。