题目内容
【题目】某钠盐溶液可能含有阴离子 NO![]() 、CO
、CO![]() 、SO
、SO![]() 、SO
、SO![]() 、Cl-、Br-、I-。为鉴定这些离子,分别取少量溶液进行以下实验:
、Cl-、Br-、I-。为鉴定这些离子,分别取少量溶液进行以下实验:
①测得溶液呈碱性;
②加HCl后,生成无色、无味气体。该气体能使饱和石灰水溶液变浑浊;
③加CCl4,滴加少量氯水,振荡后,CCl4层未变色;
④加BaCl2溶液产生白色沉淀,分离,在沉淀中加入足量盐酸,沉淀不能完全溶解;
⑤加HNO3酸化后,再加过量AgNO3溶液,溶液中析出白色沉淀。
分析上述5个实验,写出每一实验鉴定离子的结论(用“一定有”或“可能有”或“一定没有”来描述,说明理由。)。
(1)实验①_____________________________;
(2)实验②______________________________;
(3)实验③____________________________;
(4)实验④____________________________;
(5)实验⑤____________________________。
【答案】 说明可能有CO32-,或可能有SO32-,或二者都可能有,因为二者水解均显碱性 一定有CO32-,一定没有SO32-,因SO2有刺激性气味 一定没有Br-、I-,因二者均能与氯水反应生成溴单质和碘单质,溴和碘单质溶于CCl4显色 一定有SO42-,因BaSO4不溶于盐酸 可能有Cl-,因为加入硝酸银溶液,可能会产生硫酸银白色沉淀
【解析】(1)实验①:CO![]() 和SO
和SO![]() 均水解显碱性,在碱性环境下可能存在。
均水解显碱性,在碱性环境下可能存在。
(2)实验②:CO![]() 和SO
和SO![]() 均能和强酸反应生成气体二氧化碳和二氧化硫,二氧化硫气体有刺激性气味。
均能和强酸反应生成气体二氧化碳和二氧化硫,二氧化硫气体有刺激性气味。
(3)实验③:氯气能将溴离子和碘离子氧化为碘单质和溴单质,二者在四氯化碳中溶解度很大,并且均是有颜色的。
(4)实验④:向溶液中加BaCl2溶液产生白色沉淀,分离,在沉淀中加人足量盐酸,沉淀不能完全溶解,则一定含有硫酸钡。
(5)实验⑤:溶液中加HNO3酸化后,再加过量AgNO3,溶液中析出白色沉淀,可能为硫酸银沉淀,不一定为氯化银沉淀。
(1)实验①:测得混合液呈碱性,而CO![]() 和SO
和SO![]() 水解显碱性,所以在碱性环境下可能含有CO32-或者含有SO32-或二者都存在;正确答案: 说明可能有CO32-,或可能有SO32-,或二者都可能有,因为二者水解均显碱性。
水解显碱性,所以在碱性环境下可能含有CO32-或者含有SO32-或二者都存在;正确答案: 说明可能有CO32-,或可能有SO32-,或二者都可能有,因为二者水解均显碱性。
(2)实验②:CO![]() 和SO
和SO![]() 均能和强酸反应生成气体二氧化碳和二氧化硫,但是二氧化硫是有刺激性气味的气体,所以生成无色无味气体是二氧化碳,一定不存在SO
均能和强酸反应生成气体二氧化碳和二氧化硫,但是二氧化硫是有刺激性气味的气体,所以生成无色无味气体是二氧化碳,一定不存在SO![]() 离子,一定有CO
离子,一定有CO![]() 离子;正确答案: 一定有CO32-,一定没有SO32-,因SO2有刺激性气味。
离子;正确答案: 一定有CO32-,一定没有SO32-,因SO2有刺激性气味。
(3)实验③:氯气能将溴离子和碘离子氧化为碘单质和溴单质,二者在四氯化碳中溶解度很大,并且均是有颜色的;正确答案: 一定没有Br-、I-,因二者均能与氯水反应生成溴单质和碘单质,溴和碘单质溶于CCl4显色。
(4)实验④:根据硫酸根离子的检验试剂是氯化钡,可以向溶液中加BaCl2溶液产生白色沉淀,分离,在沉淀中加人足量盐酸,沉淀不能完全溶解,则一定含有硫酸钡;正确答案: 一定有SO42-,因BaSO4不溶于盐酸。
(5)实验⑤:溶液中加HNO3酸化后, 再加过量AgNO3,如果溶液中含有SO42-,Ag+与SO42-也可生成硫酸银白色沉淀,不一定会产生氯化银沉淀,所以不能确定溶液中含有氯离子;正确答案: 可能有Cl-,因为加入硝酸银溶液,可能会产生硫酸银白色沉淀。

 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案【题目】比较过氧化氢在四种不同条件下发生分解反应:2H2O2=2H2O+O2↑,其中产生O2的反应速率最大的试验编号是( )
实验编号 | 温度 | 过氧化氢的质量分数 | 催化剂 |
A | 20℃ | 4% | 无 |
B | 50℃ | 4% | 有 |
C | 20℃ | 12% | 无 |
D | 50℃ | 12% | 有 |
A. AB. BC. CD. D
【题目】“十三五”期间,云南省将推进8条支线天然气管道的建设,促成云南真正迈入“气化时代”。根据下列有关天然气的研究和应用回答问题:
(l)在一定温度和压强下,由最稳定单质生成lmol化合物的焓变称为该物质的摩尔生成焙。根据此定义,稳定单质的摩尔生成焓为0。某些化合物的摩尔生成焓如下表所示:
化合物 | CO2 | CH4 | CO |
摩尔生成焓(kJ·mol) | -395 | -74.9 | -110.4 |
CH4(g)与CO2(g)反应生成CO(g)和H2(s)的热化学方程式为______。
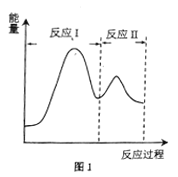
(2)若上述反应分Ⅰ、Ⅱ两步进行,其能量曲线如图1所示。则总反应的反应速率取决于反应_______(填“I”或“Ⅱ”)。
(3)一定温度下反应:CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g)的平衡常数表达式Kp=___(用平衡分压代替平衡浓度表示).
2CO(g)+2H2(g)的平衡常数表达式Kp=___(用平衡分压代替平衡浓度表示).
(4)在压强为p1、p2、p3的三个恒压密闭容器中分别通入1.0molCH4(g)与1.0mol CO2(g),发生反应:CO2(g)+CH4(g)![]() 2CO(g)+2H2(g).测得平衡时CH4的体积分数与温度、压强的关系如图2所示。
2CO(g)+2H2(g).测得平衡时CH4的体积分数与温度、压强的关系如图2所示。

① a点时CH4的转化率为_______。
② 压强p1、p2、p3由大到小的顺序为______,判断理由是_____。
温度为Tl℃、压强为P3时,b点处v(正)_____v(逆)(填“<”、“>”或“=”)。
(5)某种燃料电池以熔融碳酸钠、碳酸钾为电解质,其工作原理如图3所示,该电池负极的电极反应式为________。若电极B附近通入1m3空气(假设空气中O2的体积分数为20% )并完全反应,理论上可消耗相同条件下CH4的体积为_______m3。



