题目内容
1.19.2gCu溶于100mL浓度分别为1mol•L-1的HNO3和H2SO4的混合酸中,若产生的气体为NO,最多产生的NO在标准状况下体积为( )| A. | 2.24L | B. | 1.68L | C. | 3.36L | D. | 1.12L |
分析 先根据n=cV分别计算出溶液中氢离子、硝酸根离子的物质的量,然后根据n=$\frac{m}{M}$计算出铜的物质的量,再根据反应方程式3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O判断过量情况,根据不足量计算出生成NO的物质的量,再计算出标况下一氧化氮的体积.
解答 解:n(HNO3)=cV=1mol•L-1×0.1L=0.1 mol,n(H2SO4)=cV=1 mol•L-1×0.1 L=0.1mol,
100 mLHNO3和H2SO4混合酸溶液中,n(H+)=0.1moL+2×0.1moL=0.3mol,n(NO3-)=0.1mol,
19.2g铜的物质的量为:n(Cu)=$\frac{19.2g}{64g/mol}$=0.3mol,
3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O
3 8 2 2
0.3 0.3 0.1
0.3mol铜完全反应消耗0.8mol氢离子、0.1mol硝酸根离子完全反应消耗0.4mol氢离子,
显然氢离子不足,生成一氧化氮气体的量需要按照氢离子的物质的量计算,
则反应生成NO的物质的量为:0.3mol×$\frac{2}{8}$=0.075mol,
标况下生成的NO的体积为:22.4L/mol×0.075mol=1.68L,
故选B.
点评 本题考查了混合物反应的计算,题目难度中等,根据反应方程式及题中数据正确判断反应物过量情况为解答关键,试题培养了学生的分析、理解能力及化学计算能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.有关元素周期表的下列说法中,正确的是( )
| A. | 元素周期表有7个主族,8个副族,1个0族 | |
| B. | 同周期元素原子的最外层电子数相同 | |
| C. | 同主族元素从上到下原子半径依次减小 | |
| D. | 金属元素和非金属元素分界线附近的元素可用于制造半导体材料 |
12.下列叙述或解释事实的方程式错误的是( )
| A. | pH=1的NaHSO4溶液中:c(H+)=c(SO42-)+c(OH-) | |
| B. | 0.1 mol•L-1 CH3COOH溶液的pH>1:CH3COOH?CH3COO-+H+ | |
| C. | 用NaHCO3溶液做导电实验,灯泡发光:NaHCO3=Na++H++CO32- | |
| D. | 盛满NO2的烧瓶浸泡在冷水中,颜色变浅:NO2 (g,红棕色)?N2O4(g,无色)△H<0 |
9.设NA为阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 100mL0.2mol•L-1的AlCl3溶液中,含阳离子数目小于0.02NA | |
| B. | 标况下30 L pH=11的Na2CO3溶液中含有的OH-数为0.03NA | |
| C. | 10 mL质量分数为98%的H2SO4溶液,用水稀释至100 mL,所得H2SO4的质量分数大于9.8% | |
| D. | 11 g超重水(T2O)含中子数为5NA |
16.下列叙述Ⅰ和Ⅱ均正确并有因果关系的是( )
| 选项 | 叙述I | 叙述II |
| A | 苯甲酸的溶解度随温度升高而增大 | 用蒸发浓缩、冷却结晶、过滤,除去苯甲酸中混有的泥沙 |
| B | NH4Cl受热容易分解 | 加热NH4Cl制备NH3 |
| C | SO2具有漂白性 | SO2能使KMnO4溶液褪色 |
| D | 某温度下,碳酸的K1=4.4×10-7,次氯酸的K=2.98×10-8 | 用CO2和NaClO制备HClO |
| A. | A | B. | B | C. | C | D. | D |
6.下列有关化学用语表示正确的是( )
| A. | 中子数为21的钾原子:${\;}_{19}^{40}$K | |
| B. | 氯化钡的电子式:Ba2+[${\;}_{•}^{•}$$\underset{\stackrel{••}{ci}}{••}$${\;}_{•}^{•}$]${\;}_{2}^{-}$ | |
| C. | N3-的结构示意图: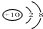 | |
| D. | 聚2-甲基-1,3-丁二烯的结构简式: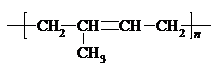 |
13.下列有关说法错误的是( )
| A. | 催化剂通过降低化学反应的焓变加快化学反应速率 | |
| B. | 反应N2(g)+3H2(g)═2NH3(g)(△H<0)达平衡后,降低温度,正反应速率增大、逆反应速率减小,平衡向正反应方向移动 | |
| C. | 反应NH3(g)+HCl(g)═NH4Cl(s)低温下能自发进行,说明该反应的△H<0 | |
| D. | 用pH均为2的盐酸和醋酸分别中和等物质的量的NaOH,消耗盐酸的体积更大 |
10.下列物质提纯的方法中正确的是( )
| A. | 除去混在NO2气体中的NO:将气体与过量O2混合 | |
| B. | 除去混在CO2气体中的SO2:将气体依次通过足量酸性KMnO4溶液和浓硫酸 | |
| C. | 除去KCl溶液中的K2CO3:加入过量的BaCl2溶液后过滤 | |
| D. | 除去乙酸中混有的乙醇:相混合液中加入生石灰后蒸馏 |
15.有一种白色晶体A,加热后可完全变成气体,其中有一种气体能使湿润的红色石蕊试纸变蓝,另一种气体能使石灰水变浑浊.在A的溶液中加入少量CaCl2溶液,看不到白色沉淀.此白色晶体可能是( )
| A. | NH4Cl | B. | (NH4)2CO3 | C. | NH4NO3 | D. | NH4HCO3 |